GZMK的表达和活性受到多种因素的调节,包括细胞因子的刺激、基因转录和翻译的控制等。在免疫系统中,GZMK的表达通常与细胞毒性淋巴细胞的活化和分化有关,其中细胞毒性T淋巴细胞又参与了多种炎症性疾病急性发作或慢性复发,这类细胞可加剧气道炎症疾病的发生和发展,其作用方式可能依赖于 GZMK的蛋白水解活性和补体系统等[2]。
慢性鼻窦炎是常见的气道炎症性疾病,影响约为10%的人群,并有较大概率伴有哮喘发生,部分患者会发展为鼻息肉且因为高复发率往往导致患者需要重复手术。近期由北京同仁医院、清华大学医学院及生命学院研究团队针联合发表于Nature的研究发现,表达GZMK的CD8+T细胞可通过激活补体级联反应,促进气道炎症和复发性气道疾病,为治疗提供了新的潜在靶点。研究通过对重复手术样本的T细胞受体(TCR)全面分析发现疾病复发时,具有效应记忆样特征的CD8+T细胞克隆会重新定植于黏膜组织,进一步鉴定出与鼻息肉(NP)复发相关的CD8+T细胞亚群T1。T1细胞在NP组织中比健康对照更丰富,且与疾病严重程度相关,其可能来源于血液 B2 细胞,并高表达GZMK。
机制研究表明,GZMK可切割补体成分C2/3/4及C5,激活补体级联反应[1],产生促炎因子C3a并促进炎症细胞的招募速度,表达GZMK的CD8+T细胞还与炎症细胞聚集形成类似三级淋巴结构,推动疾病的发展过程。在小鼠哮喘模型中,T细胞来源的GZMK通过激活C3促进嗜酸性粒细胞浸润,进而加剧气道炎症,而敲除或抑制GZMK能够减轻气道炎症,改善肺功能。
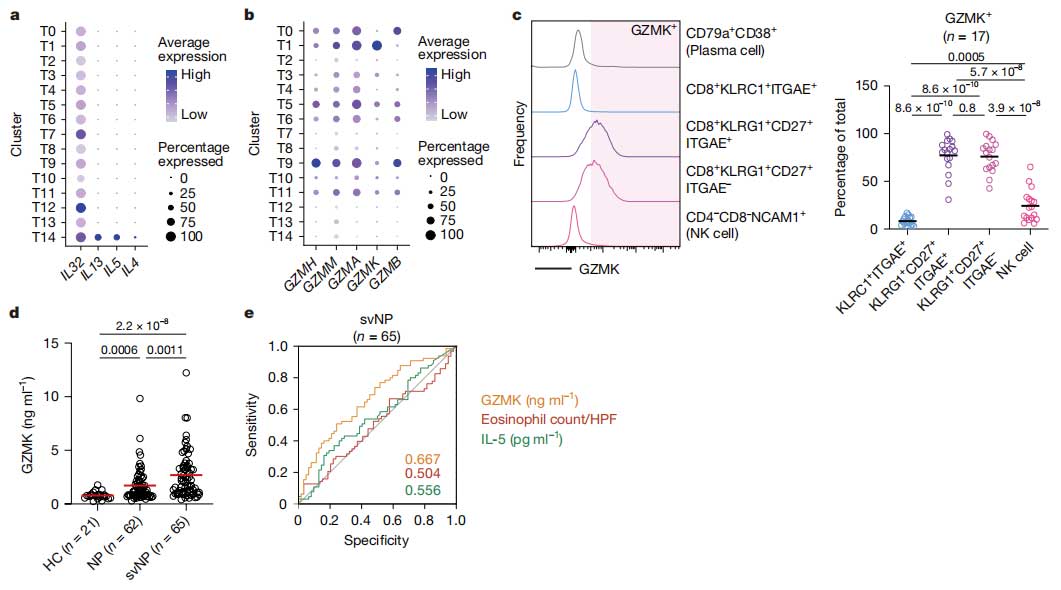
鼻息肉复发及哮喘合并症中的GZMK表达水平与发展过程[2]
此项研究揭示了表达GZMK的CD8+T细胞在复发性气道炎症性疾病中的关键作用,为该疾病的治疗提供了新的思路与靶向策略。同时,鼻炎与慢性鼻窦炎在病理机制上存在一定相似性,这个研究成果在未来可能为鼻炎领域的治疗提供了一定基础[2][3]。
不仅于此,已有多个研究证明,高表达GZMK的CD8+T细胞与多种疾病的发生发展密切相关,在肿瘤、自身免疫性疾病和其他炎症性疾病中都发挥着重要作用。
如在非转移性结直肠癌中,GZMK高表达的CD8+ T效应记忆细胞与CD15高表达的中性粒细胞丰度相关,且预示着较差的临床结局;而在胶质母细胞瘤组织中浸润的CD8+T细胞主要是经过克隆性扩增形成的GZMK阳性效应细胞群,这表明该靶点在肿瘤的发展和预后方面具有重要影响。在对自身免疫性疾病及多种炎症性疾病的研究当中同样发现病变组织内均可检测到表达GZMK的CD8+T细胞,如类风湿关节炎、狼疮性肾炎、原发性干燥综合征等。在多发性硬化症中,脑部浸润的CD8+T细胞同样以克隆性扩增的形式持续存在于脑脊液和血液中,此类研究虽未完全揭示其机制,但仍提示其可能参与疾病的发生和发展过程,并对疾病的治疗性研究方向展现出重要的参考价值。
发表于Cell的 “Contrasting cytotoxic and regulatory T cell responses underlying distinct clinical outcomes to anti-PD-1 plus lenvatinib therapy in cancer”研究通过对联合治疗的肿瘤案例中发现了浸润在肿瘤组织中且高表达GZMK的效应记忆CD8+T细胞。该T细胞群由耗竭前体T(Tpex)细胞与一种富含乙型肝炎病毒(HBV)特异性的循环Tem细胞组成。这个发现表明了GZMK的表达与肿瘤组织浸润的特定T细胞群有关,且该T细胞群在有效治疗的情况下仍然存在于肿瘤组织中,进一步提示了GZMK可作为一种标志物用于判断治疗手段是否有效,并可为肿瘤免疫治疗提供新的思路或靶点研究方向[4]。
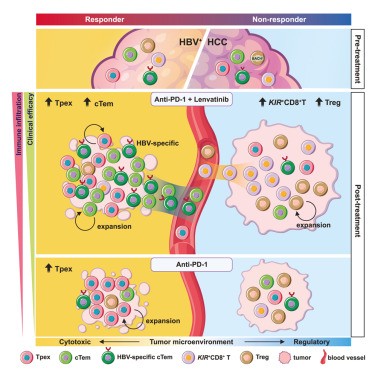
浸润在肿瘤组织中高表达GZMK的CD8+T细胞的免疫差异[4]
根据研究证明GZMK可在多种疾病的进程中扮演着关键角色并均可影响病情的发展与预后。无论是作为新靶点思路,还是判断治疗效果的潜在标志物,它都展现出了极高的研究价值与应用潜力。