Receptor tyrosine-kinase-like orphan receptor 1(受体酪氨酸激酶样孤儿受体1, ROR1)是一种I型跨膜蛋白,在胚胎发育过程中,参与细胞的迁移、增殖和分化等重要生理活动,但在妊娠晚期会下调表达,并随着人体生长逐渐在大多数健康组织中趋近消失。多项研究发现,ROR1在脂肪组织、胰腺、肺、少量B前体细胞中低表达,在其他正常细胞中表达有限或不表达。而在多种肿瘤细胞中高度表达并具有明显异质性,包括某些血液系统肿瘤(如慢性淋巴细胞白血病、边缘区淋巴瘤等)和实体瘤(如乳腺癌、卵巢癌、肺癌等),这使得 ROR1在目前被公认为是一个非常有潜力的肿瘤治疗靶点。
上图为乳腺癌细胞
ROR1胞外的富含半胱氨酸结构域(CRD)的配体Wnt5a是非经典Wnt信号通路的激活因子,CRD与之结合后可异常激活ROR1并诱导ROR1受体发生构象变化,同时使得ROR1能与下游信号分子相互作用,从而启动一系列的信号转导事件。研究证明,ROR1被激活后可导致Dvl2/3的激活和Akt的磷酸化,进而促进IKKα的磷酸化以激活IKK复合物,该复合物负责IκBα的降解和NF-κB亚基p65磷酸化,而p65的磷酸化会进一步激活NF-κB信号通路,并促使细胞迁移、侵袭、EMT及癌转移等进程,且磷酸化的p65会被转移到细胞核以促进靶基因的转录和表达从而抑制p38,当p38被抑制后,会使肿瘤细胞的增殖、存活及转移等发展进一步得到促进,肿瘤细胞的凋亡进程反而得到减缓[1-3]。
在针对血液瘤的研究中,科学家发现 ROR1在不同血液肿瘤中的表达具有明显的异质性,其中以慢性淋巴细胞白血病(CLL)和毛细胞白血病(HCL)阳性率最高,急性髓系白血病(AML)及T细胞非霍奇金淋巴瘤(T-NHL)几乎无表达,而三阴性乳腺癌的表达量介于二者之间[4]。基于这种发现,科学家们利用ROR1作为靶点治疗癌症的新型方法采用了不同的治疗策略。
在针对白血病的研究中,科研人员利用靶向ROR1胞外Ig-like/FZD的mAb 2A2制备了2A2 CAR-T,并截短其间隔区域从而实现了对ROR1阳性肿瘤的识别。在此基础上利用兔抗人ROR1 mAb R12制备了R12 CAR-T,并发现后者具有更强的亲和力,针对体内ROR1阳性B细胞淋巴瘤和体外多种上皮性肿瘤均表现出良好的反应活性。随后,通过对R12 CAR-T的间隔区域进行改造与修饰,显著提升了其对ROR1阳性肿瘤的识别能力,并扩大了T淋巴细胞的生物学效应[5-7]。
三阴性乳腺癌在临床上进展快、恶性程度高且预后差、易复发,目前治疗手段非常有限,研究人员开发出的ROR1 CAT-T在针对三阴性乳腺癌的体外实验中发现阳性靶细胞MDA-MB-231,并在对照实验中发现ROR1 CAR-T对于癌细胞具有特异性杀伤效果且脱靶性的危险较小[8]。另一组实验发现ROR1 CAR-T在人体实验中并未发现明显的计量限制性毒性,肿瘤明显缩小[9]。
此外,由Harald Kolmar与Xueyuan Zhou的团队发表于《Frontiers in Immunology》的研究利用ROR1不同结构域的抗体来构建T细胞衔接器(TCE),研究不同格式TCE对肿瘤细胞的杀伤能力和细胞因子释放情况。其中利用纳米抗体筛选出可以结合ROR1远端区域的VHH 5A1,并构建多种含5A1的TCE,并对其中一种进行优化后得到ROR1特异性hum-VHH-2-LC的TCE,它能将细胞毒性与细胞因子释放解耦,具有宽细胞因子窗口,可提高T细胞适应性,在体外和体内实验中均表现出良好性能,对肿瘤细胞的连续杀伤能力比其他TCE更为有效,可诱导异质性肿瘤的IFNγ依赖性杀伤,并有利于维持T细胞的适应性。同时,在小鼠模型实验中表明hum-VHH-2-LC在所有测试剂量下均能抑制肿瘤生长且较于其他TCE的毒性很小,为实体瘤和血液瘤治疗提供了潜在有效策略[10]。
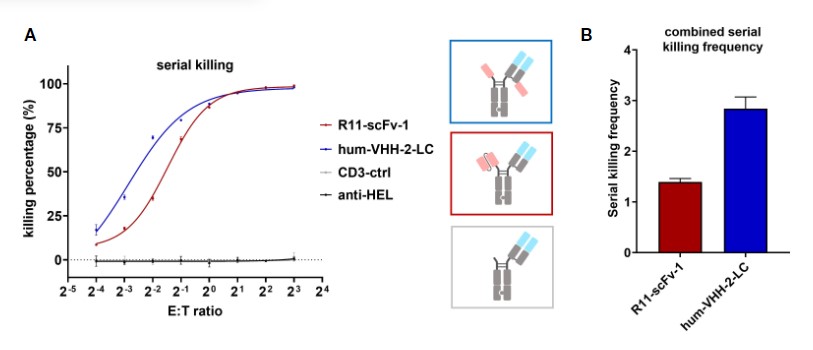
Hum-VHH-2-LC可诱导更出色的连续杀伤作用
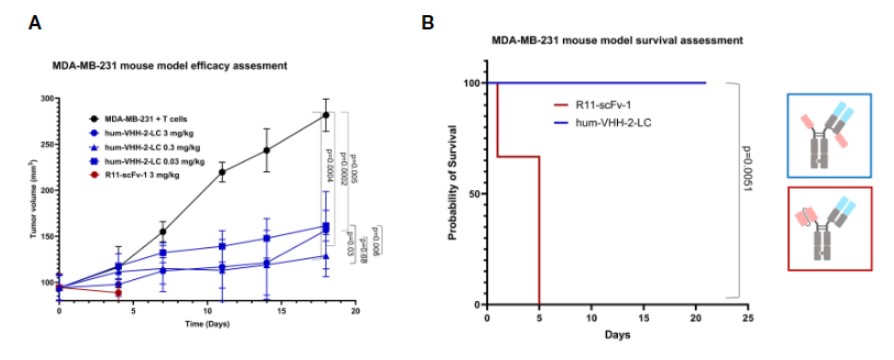
Hum-VHH-2-LC更出色的肿瘤抑制效果
通过靶向ROR1的不同策略,如制备各种CAR-T细胞以及基于纳米抗体和ROR1的结合性研究为实体瘤和血液瘤治疗提供了新的潜在有效策略。未来,ROR1与纳米抗体相关研究有望继续深入,为攻克癌症难题提供更多有力的解决方案,在肿瘤精准治疗的道路上不断取得新的突破。

纳博生命推出多平台抗体筛选技术(噬菌体展示/大肠杆菌展示/哺乳动物细胞展示)及双抗构型抗体筛选技术,助力抗体药物及试剂的研发,为广大机构提供灵活的抗体筛选技术选择、更高的可成药性以及多种靶点的预制免疫文库。
我们专注于纳米抗体的开发、改造与应用,拥有符合实验动物标准的羊驼繁育基地与独立实验基地。致力于构建产、学、研一体化的实验公共服务平台。希望能为广大生物科研机构、医药研发企业和创新团队提供更专业、性价比更高的实验服务。同时,纳博生命也正针对文中纳米抗体进行开发,欢迎各方研发人员与我们交流联系。
参考资料:
[1]Zhu J .The possibility of MSLN, ANTXR1, and ROR1 to become the target of CAR T cell therapy for treating TNBC and lung cancer[C]//Eliwise Academy.Proceedings of the 2nd International Conference on Biological Engineering and Medical Science(part7).School University of Leeds;,2022:5.DOI:10.26914/c.cnkihy.2022.090413.
[2] Wang Z, Li N, Feng K, Chen M, Zhang Y, Liu Y, et al. Phase I study of CAR-T cells with PD-1 and TCR disruption in mesothelin-positive solid tumors. Cell Mol Immunol. 2021 Sep;18(9):2188–98.
[3] Yamaguchi T, Yanagisawa K, Sugiyama R, Hosono Y, Shimada Y, Arima C, et al.NKX2-1/TITF1/TTF-1-Induced ROR1 Is Required to Sustain EGFR Survival Signaling in Lung Adenocarcinoma. Cancer Cell. 2012 Mar 20;21(3):348–61.
[4] Silva MA, Williams S, Hauert S, Ovadia B, Gupta I, Waldmeier L, Jaimes Y, Al-Masri H. Tumour assessment of ROR1 levels in various adult leukaemia and lymphoma types. PLoS One. 2024 Nov 4;19(11):e0313026. doi: 10.1371/journal.pone.0313026. PMID: 39495778; PMCID: PMC11534244.
[5] Hudecek M,Sommermeyer D,Kosasih PL,et al. The nonsignaling extracellular spacer domain of chimeric antigen receptors is decisive for in vivo antitumor activity [J]. Cancer Immunol Res,2015,3 ( 2) : 125 - 135
[6] Yang J,Baskar S,Kwong KY,et al. Therapeutic potential and challenges of targeting receptor tyrosine kinase ROR1 with monoclonal antibodies in B - cell malignancies [J]. PLoS One,2011,6 ( 6 ) : e21018 16
[7] Hudecek M,Lupo - Stanghellini MT,Kosasih PL,et al. Receptor affinity and extracellular domain modifications affect tumor recognition by ROR1 - specific chimeric antigen receptor T cells[J]. Clin Cancer Res,2013,19( 12) : 3153 - 3164 17
[8] 陈玥,莫泽明,秦笛源,等. 靶向 ROR1 的嵌合抗原受体修饰 T 细胞的构建及对 ROR1 阳性肿瘤细胞的杀伤作用 [J]. 四川大学 学报: 医学版,2019,50( 2) : 145 - 151
[9] Jaeger-Ruckstuhl CA, Specht JM, Voutsinas JM, MacMillan HR, Wu QV, Muhunthan V, Berger C, Pullarkat S, Wright JH, Yeung CCS, Hyun TS, Seaton B, Aicher LD, Song X, Pierce RH, Lo Y, Cole GO, Lee SM, Newell EW, Maloney DG, Riddell SR. Phase 1 Study of ROR1 Specific CAR T Cells in Advanced Hematopoietic and Epithelial Malignancies. Clin Cancer Res. 2024 Oct 28. doi: 10.1158/1078-0432.CCR-24-2172. Epub ahead of print. PMID: 39466024.
[10] Zhou X, Geyer FK, Happel D, Takimoto J, Kolmar H, Rabinovich B. Using protein geometry to optimize cytotoxicity and the cytokine window of a ROR1 specific T cell engager. Front Immunol. 2024 Feb 22;15:1323049. doi: 10.3389/fimmu.2024.1323049. PMID: 38455046; PMCID: PMC10917902.