在开发新型治疗性抗体药物中,传统抗体常受限于体积大、稳定性差、生产成本高、难以穿透复杂组织或靶向隐藏的病原体表位等因素。在此背景下,Nadine Biesemann研究团队基于纳米抗体穿透性强、稳定性高、易于工程化改造的优势开发出一种双特异性抗TNF/IL-6纳米抗体,并发表于《Science·Translational Medicine》。这种双特异性纳米抗体在RA模型中展现出协同治疗突破性优势,为靶向多通路协同治疗提供了新方向。
双特异性纳米抗体的设计与机制突破
该研究设计出一种命名为Compound 1的双特异性纳米抗体,可同时靶向TNF及IL-6,且支持每周一次给药。这种设计将抗TNF的VHH与抗IL-6的VHH通过柔性连接肽(如GGGGS)串联,形成双特异性单体,并在其结构末端融合人IgG1-Fc片段,通过结合新生儿FcRn延长其半衰期,然后通过噬菌体展示库筛选或定点突变,确保两个VHH结构域分别结合TNF和IL-6的非竞争性表位,避免了空间位阻。
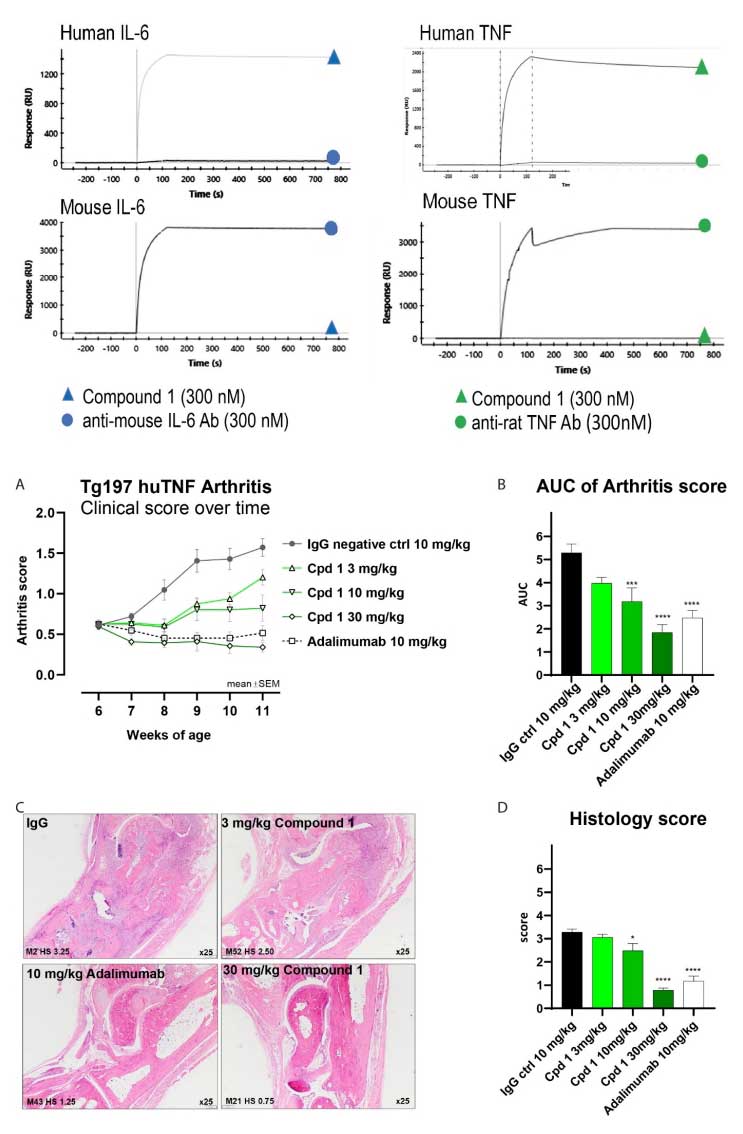
为确保该双抗具有高亲和力与双靶点协同效应,研究团队通过SPR和动力学排除实验发现,Compound 1对人类及食蟹猴TNF和IL-6表现出纳摩尔级亲和力(Kd <1 nM),但对小鼠TNF/IL-6无结合活性。这种物种特异性使其适用于临床前灵长类模型,同时避免了小鼠实验中潜在的脱靶效应。
在RA患者滑膜成纤维细胞(FLS)与CD4+ T细胞共培养模型中,TNF(1 ng/Ml)与IL-6/sIL-6R(10-100 ng/mL)联合刺激显著激活“滑膜成纤维细胞在RA中的作用”通路(z-score=-12.8,p=1.7×10-19),促进白细胞浸润、基质降解和软骨破坏。而Compound 1通过同时阻断TNF和IL-6信号,使该通路活性评分逆转(z-score=-2.3,p=9.9×10-9),抑制炎症级联反应。
双特异性纳米抗体可同时靶向TNF及IL-6并抑制RA形成
临床前模型中的显著疗效
在进一步的研究中,研究团队采用Tg197转基因小鼠模型(过表达人TNF,自发展慢性关节炎)评估Compound 1的治疗潜力。结果显示,双靶点纳米抗体在关节炎症和结构保护方面均优于现有单药疗法。
实验将小鼠模型从6周龄开始分别接受Compound 1(3-30mg/kg)、阿达木单抗(10 mg/kg)或对照抗体进行治疗,每周两次,直至11周龄。结果显示采用30mg/kg的Compound 1小鼠组在第11周临床关节炎评分较对照组降低85%(p<0.0001),疗效显著优于阿达木单抗。且在组织学评分方面,Compound 1治疗组关节滑膜增生、炎症细胞浸润和骨侵蚀程度显著减轻,较对照组下降70%(p<0.0001),呈剂量依赖性。
同时,研究团队这种双靶点协同效应可以通过双信号通道抑制Th17极化。Th17细胞是RA中致病性T细胞亚群,其分化受TNF和IL-6共同调控。在FLS/T细胞共培养模型中,Compound 1通过抑制IL-6/STAT3和TNF/NF-κB信号,使Th17信号通路活性大幅下降(z-score=-2.7,p=2.6×10-6),减少IL-17等促炎因子分泌。这一机制可能解释其长效抗炎效果。

双特异性纳米抗体双通路抑制作用的协同疗效
安全性及生产考量
在针对免疫原性的验证中,这种人源化纳米抗体可显著降低抗药物抗体(ADA)风险,临床前灵长类实验未报告显著免疫反应,在转基因小鼠中未见肝肾功能异常,但仍需进一步评估长期免疫抑制导致的感染风险。
同时,研究团队采用哺乳动物细胞表达系统,通过亲和层析和尺寸排阻色谱纯化,确保了双特异性结构的正确折叠与高产率。
双特异性纳米抗体优势与潜力
传统的单药靶向TNF或IL-6仅能部分阻断炎症网络,而该研究证实了双特异性纳米抗体的双通道协同抑制策略可以打破TNF及IL-6的正反馈环路,显著降低滑膜中促炎因子(如IL-6、CXCL10)和基质金属蛋白酶(MMP-3、MMP-9)的表达,实现更全面的炎症控制;在耐药性方面,RA患者长期使用传统的单靶点药物常因代偿性通路激活而失效,而Compound 1可逆转滑膜成纤维细胞活化及Th17极化,延缓耐药机制的发生。同时,通过融合新生儿FcRn后显著延长了其半衰期,支持每周一次给药,可大幅提升患者依从性,这些机制使其成为RA治疗的革新性候选药物。
此外,除了直接治疗,纳米抗体的模块化设计为RA预防策略提供了新思路。在体外诊断及监测方面,荧光标记的纳米抗体可实时成像滑膜炎症活动,指导精准治疗;在联合治疗策略上,纳米抗体与JAK抑制剂或IL-17拮抗剂联用,可能进一步突破难治性RA的治疗瓶颈;甚至在针对RA的疫苗开发中,纳米抗体可作为载体靶向RA关键抗原,递送免疫调节分子至病变关节,诱导抗原特异性免疫耐受。
不仅于此,纳米抗体的模块化设计思路还可支持快速开发靶向其他细胞因子(如IL-1β、GM-CSF)的多特异性抗体。未来,纳米抗体或将成为自身免疫性疾病领域的“瑞士军刀”,为患者提供更安全、长效的治疗选择。

纳博生命现拥有覆盖抗体开发到抗体发现,再到抗体工程的全链路技术平台。其中包括噬菌体展示、大肠杆菌展示、哺乳动物细胞展示等筛选平台,膜蛋白制备及mRNA免疫平台。通过多平台的交叉互补为药企及科研院所提供灵活的抗体发现及改造服务,助力药物试剂的研发。
纳博生命专注于纳米抗体开发、改造与应用,拥有符合实验动物标准的羊驼繁育基地与独立实验基地。致力于构建产、学、研一体化的实验公共服务平台。希望能为广大生物科研机构、医药研发企业和创新团队提供更专业、性价比更高的实验服务。
更多服务内容,请关注纳博生命公众号或拨打官方电话400-822-9180进行咨询!
参考资料:Additive efficacy of a bispecific anti–TNFIL-6 nanobody compound in translational models of rheumatoid arthritis