大脑发育的“导航仪”与癌症的“帮凶”
FZD3是Frizzled家族中的特殊成员,与FZD6共同归类为“非经典Wnt信号通路”受体。在神经退行性疾病中,FZD3失调与帕金森病相关;在癌症领域,FZD3高表达直接推动肝癌和黑色素瘤的恶化进程。它的核心功能体现在以下两大方面:
1、神经系统的构建者与维护者
- 轴突导向:在胚胎发育中,FZD3为神经轴突提供方向指引。缺失FZD3的小鼠会出现前脑神经纤维束缺失和脊髓运动神经变细,导致神经传导功能障碍;
- 神经嵴细胞迁移:FZD3调控神经嵴细胞(发育为外周神经、面部骨骼的关键细胞)的定向迁移,其异常与先天性巨结肠症(Hirschsprung病)相关;
- 平面细胞极性(PCP)建立:在脊椎动物神经板中,FZD3通过PCP通路协调细胞定向排列,确保神经管正常闭合。
2、癌症进展的“推手”
- 促癌信号放大器:FZD3在肝癌、B细胞慢性淋巴细胞白血病、黑色素瘤等多种癌症中高表达。在黑色素瘤中,敲低FZD3可显著抑制肿瘤生长和转移;
- 干细胞特性维持:通过激活Wnt通路,FZD3帮助癌细胞维持干细胞特性,增强耐药性和复发风险。
破局关键工具,解译FZD3调控密码
FZD家族是公认的重要药物靶点,从科学研究层面看,FZD受体的结构生物学研究已取得重要突破:FZD4/5/7的TMD跨膜结构域揭示了其作为GPCR的典型七次跨膜折叠特征。然而,FZD3/6亚家族的全长受体结构因胞外区(CRD和linker)的高度柔性难以解析,尤其是 CRD与TMD之间的动态关系,阻碍了理性药物的设计。其次,10种人源FZD亚型的结构高度相似,这种亚型特异性差的问题导致传统抗体难以区分,易产生脱靶效应。
目前进入临床的FZD靶向药多为传统单抗,但传统抗体分子量大、组织穿透性弱,且无法靶向胞内表位。在此背景下,研究团队全长FZD3作为抗原对羊驼进行免疫,通过多轮噬菌体展示筛选后获得7个高特异性纳米抗体(Nb1、3-6、8-9)。其中Nb8特异性结合FZD3 CRD(Kd=19.2nM),仅微弱结合FZD6;Nb9高亲和力结合FZD3胞内区(Kd=32nM)。
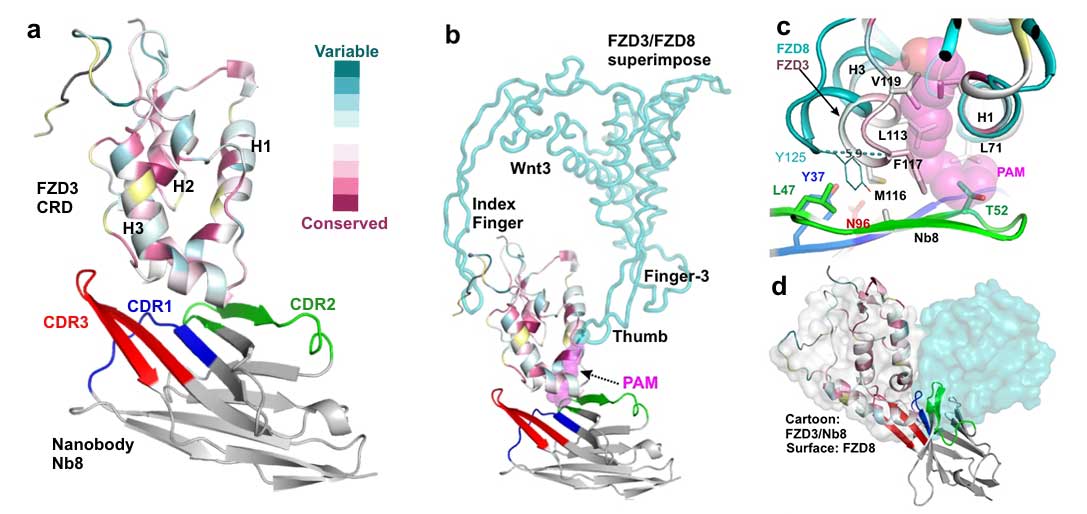
为解析Nb8与FZD3 CRD的相互作用机制,研究团队成功解析了Nb8-FZD3 CRD复合物结构的1.8Å分辨率晶体结构。结构显示,FZD3 CRD 虽在序列上与其他 FZD 家族成员有所差异,却保持着进化保守的折叠模式,与 FZD2/4/5/7/8 的Ca原子均方根偏差(RMSD)仅为 1.2-1.6Å。
Nb8通过三个互补决定区(CDRs)形成凹面结合在FZD3 CRD的脂质结合槽底部,其CDR2环上的T52残基直接阻碍Wnt配体(棕榈油酸)基团的插入。同时,这种结合破坏了CRD二聚化界面,直接阻断了Wnt信号激活。进一步的结构分析还发现,FZD3特有的M116残基与Nb8形成多重疏水作用,而FZD3/6 亚家族特有的K112残基则贡献了静电互补性,这解释了Nb8为何具有高度的FZD3特异性。
Nb8-FZD3 CRD复合物关键结构解析(图1)
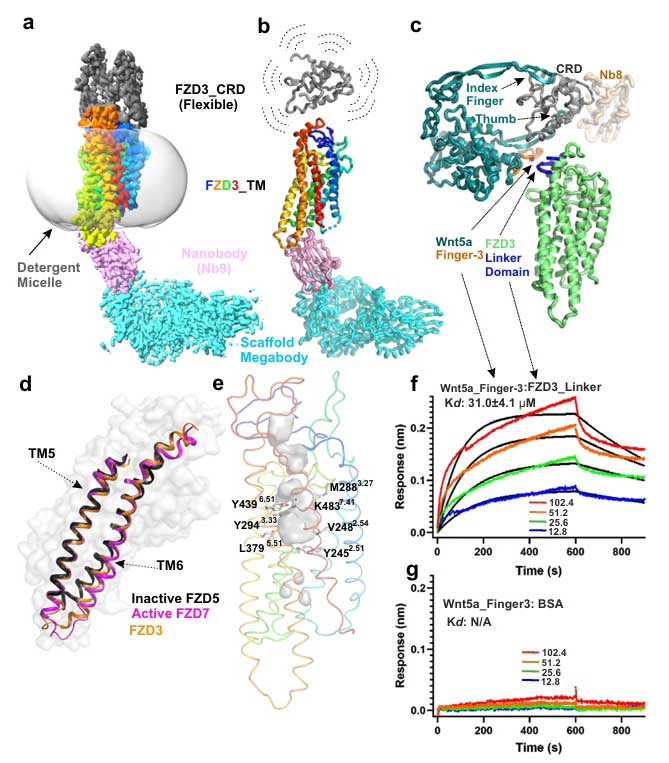
为探索FZD3的完整信号传导机制,研究团队利用Nb9构建成为“巨抗体”,以增加分子量来提升冷冻电镜成像质量,而后通过冷冻电镜解析了2.9Å分辨率的FZD3-Nb9复合物结构。解析结果发现其胞外CRD相对于了FZD3 TMD具有位置灵活性,模型拟合结果表明FZD3 CRD与Wnt5a的“手指-3”发夹结构存在特异性互作。BLI实验证实,Wnt5a手指-3肽段与FZD3 linker肽段的结合亲和力达Kd=31.0±4.1μM,这为Wnt-FZD特异性识别提供了新机制:除CRD“拇指”和“食指”结合机制外,linker与Wnt手指-3的互作可能参与了信号通路的选择。
同时,这一结构首次揭示了FZD3 TMD的激活态构象:其七次跨膜螺旋排列与激活态 FZD7高度相似,TM6向外移动形成G蛋白结合口袋,而传统认为存在的amphipathic螺旋8则未被观察到。
Nb9-FZD3全长复合物冷冻电镜结构解析(图2)
纳米抗体调控FZD3信号的“双重奏”
基于以上结构发现,研究团队开展了一系列功能验证实验,进一步揭示了纳米抗体调控FZD3信号的“双重策略”。
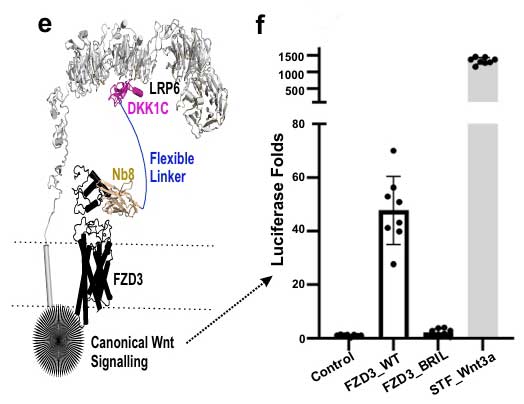
研究人员将Nb8与Dickkopf1 C端模块DKK1C融合,构建双价Wnt替代分子Nb8_DKK1C-Fc并进行功能验证,实验中结果表明在缺乏内源性FZD的细胞中,该融合蛋白激活β-catenin信号通路,荧光素酶活性较基线提高40倍以上,而插入热稳定蛋白BRIL的FZD3-BRIL突变体则对此无活性。实验证明“非经典”FZD3也可触发经典Wnt信号,这一发现打破了传统认知。
Nb8-DKK1C融合蛋白与激活策略(图3)
另一方面,Nb9则扮演了“红灯”的角色。BLI竞争实验显示,Nb9结合在FZD3胞内区的DVL口袋,可有效阻断DVL的DEP结构域与FZD3的结合;在细胞水平,Nb9融合蛋白可显著抑制DEP-mVenus的膜定位,阻止DVL招募。更重要的是,BRET实验证实Nb9可干扰 FZD3与Gαs蛋白的偶联,净BRET值由正转负,表明其抑制了G蛋白信号通路的激活。
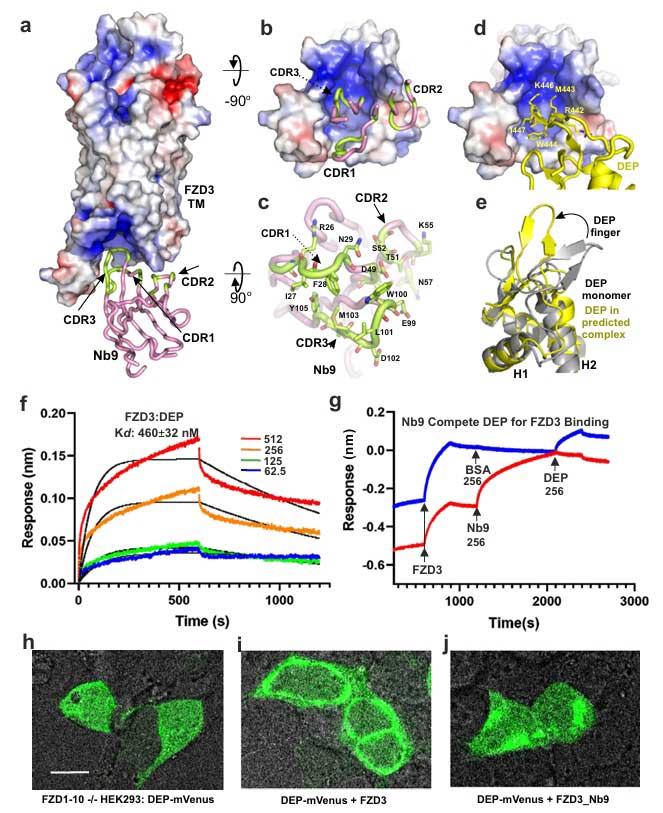
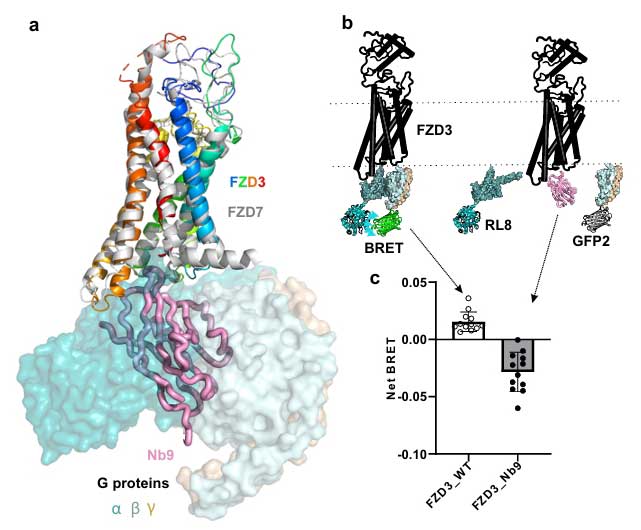
Nb9的胞内调控机制(图4-5)
癌症、神经损伤与再生医学的曙光
本研究不仅首次揭示了FZD3的全长结构和工作机制,更展示了纳米抗体作为多功能分子工具的独特价值。基于这项研究的发现,两种纳米抗体衍生策略所产生的的积极效应在多种难治性疾病的治疗领域中展现出巨大潜力。
Nb8可阻断Wnt与FZD3结合,抑制促癌信号的同时可借由高特异性避免误伤其他FZD亚型,在肝癌、黑色素瘤、白血病等FZD3高表达癌症的治疗领域提供了创新思路;Nb9可精准调控DVL或G蛋白信号,促进轴突再生,且纳米抗体具有高靶向性及穿透血脑屏障的特性使其在脊髓损伤、帕金森病、先天性神经管缺陷等神经修复与退行性疾病的治疗领域中提供了优秀思路;而Nb8-DKK1C融合蛋白可模拟Wnt功能,激活干细胞增殖与分化,在组织器官损伤修复领域同样具有巨大的潜力。
在未来,我们相信随着技术的成熟,纳米抗体将迎来更多针对“不可成药”靶点的突破性疗法。