因此,科研人员采用纳米抗体对溶瘤病毒的基因层面进行重编程,为攻克GBM的靶向难题带来了曙光。此项研究发表于Cell子刊《Molecular Therapy: Oncolytics》,本文将解读纳米抗体在此项研究中的关键作用。
纳米抗体×溶瘤病毒:精准制导系统的构建
由于GBM肿瘤细胞像树根一样浸润正常脑组织,手术无法彻底清除,且肿瘤细胞中约有1%~5%的高表达CXCR4的GSCs隐藏在脑室下区等特性使得传统治疗手段难以有效的扼制病程进展,患者的中位生存期仅16个月,复发率近100%。因此,必须寻找能够穿透血脑屏障且能精准靶向GSCs,同时激活免疫机制的疗法,而嵌合了纳米抗体的溶瘤疱疹病毒恰好匹配这些需求。
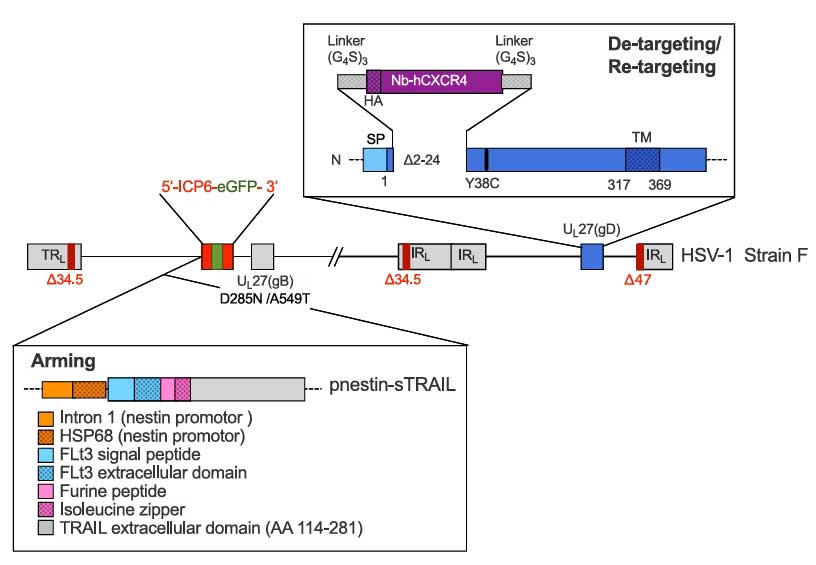
传统oHSV感染依赖天然受体CD111,但约20%的GBM细胞低表达该受体,需重靶向策略。因此,研究团队将HSV-1作为骨架并删除ICP34.5/ICP6/ICP47基因以降低神经毒性,同时突变gD蛋白的Y38C位点,阻断其与天然受体nectin-1的结合,避免误伤正常细胞;而后在其gD蛋白的HVEM天然受体结合域中,插入了一株高亲和力的抗人 CXCR4纳米抗体增强溶瘤病毒的靶向性,并在病毒基因组中引入gB蛋白的D285N/A549T突变,增强病毒与靶细胞的膜融合效率;最后插入巢蛋白启动子驱动的可溶性TRAIL(sTRAIL)诱导肿瘤细胞凋亡。
图1:oHSV/Nb-gD 病毒基因组改造示意图
体外验证:纳米抗体驱动的“精准猎杀”
为了验证该嵌合体对于GSCs的作用,研究团队通过基因改造细胞系和原代肿瘤细胞,同时验证oHSV/Nb-gD与oHSV/ gD在“人工高表达”和“天然异质性”场景下的靶向灭杀能力。
研究人员采用天然低表达CXCR4的U87MG细胞用于验证病毒靶向,并将U87MG细胞通过慢病毒转导人CXCR4基因构建成高表达CXCR4的同系细胞作为阳性对照。其次,从4例GBM患者的肿瘤组织中分离并培养了保留GSCs特性的肿瘤悬浮球,这些悬浮球的GSCs所表达的CXCR4阳性率差异显著,用来模拟临床肿瘤异质性。
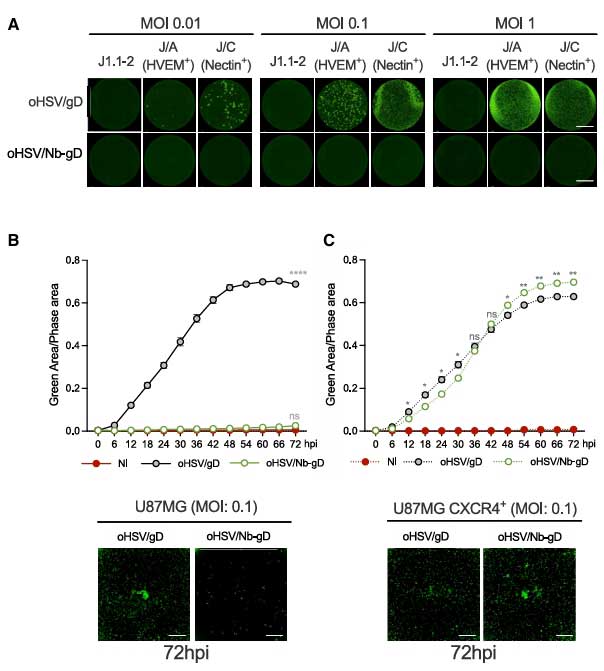
在流式细胞术和共聚焦显微镜观察下发现,纳米抗体介导的溶瘤病毒具有高度特异性。实验结果显示,在缺乏CXCR4的J1.1-2细胞中,oHSV/Nb-gD完全无法形成感染灶,而野生型oHSV/gD则可高效感染。免疫荧光显示,oHSV/Nb-gD感染的GSCs中,病毒颗粒与CXCR4 在细胞膜表面呈现明显共定位趋势。
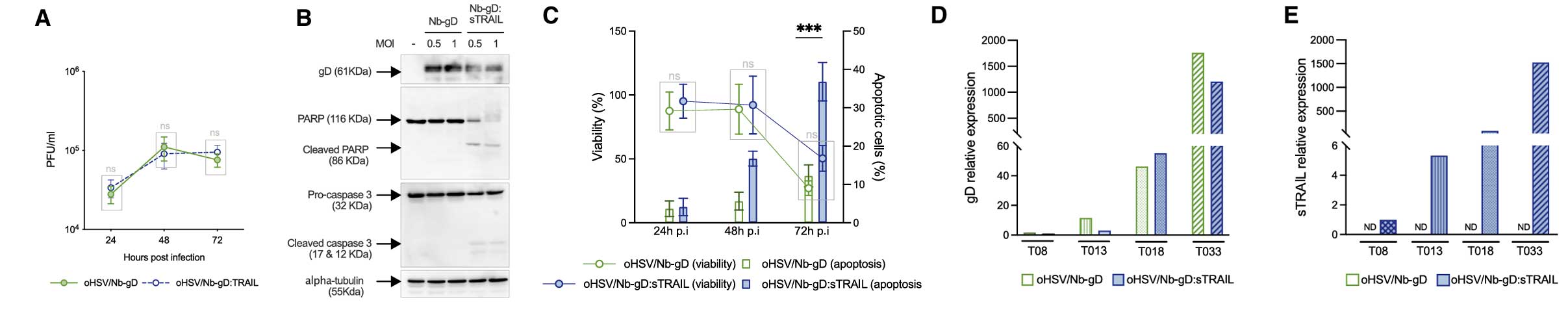
在人工改造的细胞系与原代GSCs的对比结果中发现:oHSV/Nb-gD对于U87MG细胞的感染率与CXCR4的表达水平正相关,对于经慢病毒转导高表达CXCR4的U87MG细胞的感染效率相较于未转导的细胞提10倍以上,在72小时后通过荧光显微镜下仍可见大量感染灶。而在患者原代GSCs的感染实验中发现,病毒感染率与CXCR4的表达水平正相关,其中CXCR4阳性率达75%的原代GSCs感染率约34.8%,而低表达CXCR4的GSCs感染率则不足2%。其次,插入sTRAIL的溶瘤病毒(oHSV/Nb-gD:sTRAIL)在感染CXCR4+细胞后,72小时凋亡率达36%,是oHSV/Nb-gD病毒的3倍,且24小时内触发caspase3/PARP的裂解速度显著增加。
图2A:溶瘤疱疹病毒靶向特异性验证
图2B:溶瘤疱疹病毒感染与杀伤能力验证
体内实验:肿瘤生长停滞/生存期显著延长
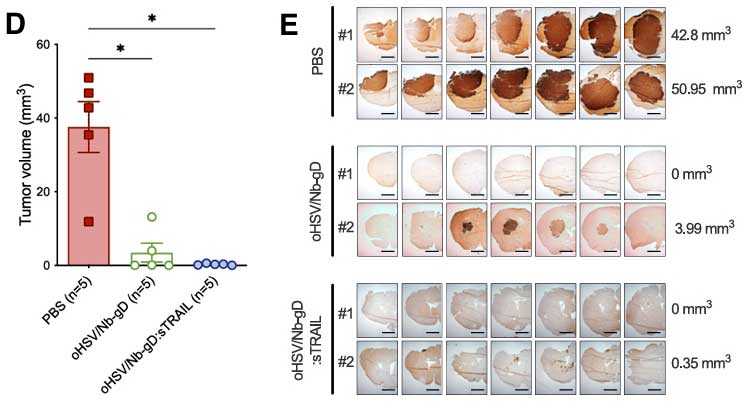
为进一步确认oHSV/Nb-gD及oHSV/Nb-gD:sTRAIL对于肿瘤的治疗效果,研究团队在U87MG CXCR4+原位异种移植的小鼠模型中,分别单次瘤内注射两种病毒,同时设置PBS组进行对照。
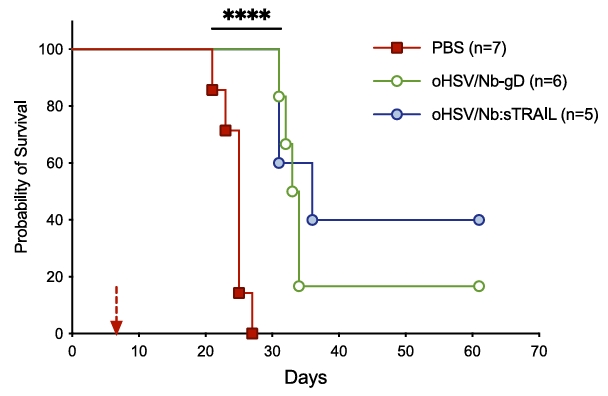
结果发现,经由纳米抗体介导的溶瘤病毒的肿瘤体积治疗组较PBS组均减少60%以上,肿瘤荧光信号降低80%,肿瘤生长曲线显著放缓。且PBS组的小鼠中为生存期为21~27天,而oHSV/Nb-gD组小鼠首次死亡出现在第31天,一直持续至61天时仍有16.7%的小鼠存活,而oHSV/Nb-gD:sTRAIL组存活率更达40%。
更重要的是,经由纳米抗体介的两个病毒治疗组小鼠的体重在注射病毒后仅呈短暂下降,然后恢复增长,脑组织中未检测到病毒对正常细胞的显著损伤。
图3A:纳米抗体溶瘤病毒组小鼠肿瘤体积缩小
图3B:纳米抗体溶瘤病毒组小鼠生存期显著延长
纳米抗体技术开启脑区抗癌新时代
“这项研究不仅是技术突破,更为实体瘤治疗提供了模块化解决方案”——通讯作者Catherine Sadzot-Delvaux教授。
由于GBM肿瘤微环境的特性以及血脑屏障的阻碍,使得纳米抗体-溶瘤病毒复合体有望成为眼下既可以穿透血脑屏障,又能精准靶向灭杀GSCs的最优秀的治疗策略。且研究发现,oHSV/Nb-gD感染GSCs后,会诱导肿瘤微环境中NK 细胞和巨噬细胞的募集。这提示该疗法可能与免疫检查点抑制剂联用,形成“溶瘤+免疫激活”的双重打击模式。
随着纳米抗体技术不断迭代,更多的难治性肿瘤都有望以纳米抗体的优秀特性开辟治疗新路径。