法国蒙彼利埃大学的Philippe Marin团队发表于《Science Advances》的研究中利用纳米抗体技术,首次揭示mGlu2受体在精神分裂症中的作用机制。问题核心在于mGlu2与mGlu3受体氨基酸序列相似度高达70%,传统技术难以区分二者。更关键的是,GPCR的信号传导往往依赖于受体相互作用组来发挥作用。如同指挥官需要通过参谋部传达指令一样,mGlu2受体必须通过与TrkB受体形成动态复合物才能发挥抗精神分裂的作用。
——“要破解mGlu2的生物学密码,首先需要一张它在真实脑环境中的‘社交网络图’。”论文通讯作者Philippe Marin教授指出,“而这正是纳米抗体赋予我们的超能力。”
绘制mGlu2的“社交图谱”
研究团队采用自主开发的双特异性纳米抗体,对小鼠前额叶皮层中的天然mGlu2进行精准捕获。这种纳米抗体采用双结合域设计,如同“分子镊子”,对mGlu2的亲和力达0.30±0.04 nM,且不受受体构象影响,无论受体结合激动剂还是拮抗剂均能稳定结合。通过免疫组织化学验证,该纳米抗体仅在野生型小鼠脑内产生强标记信号,而在mGlu2基因敲除的小鼠中无信号,证实了其特异性。
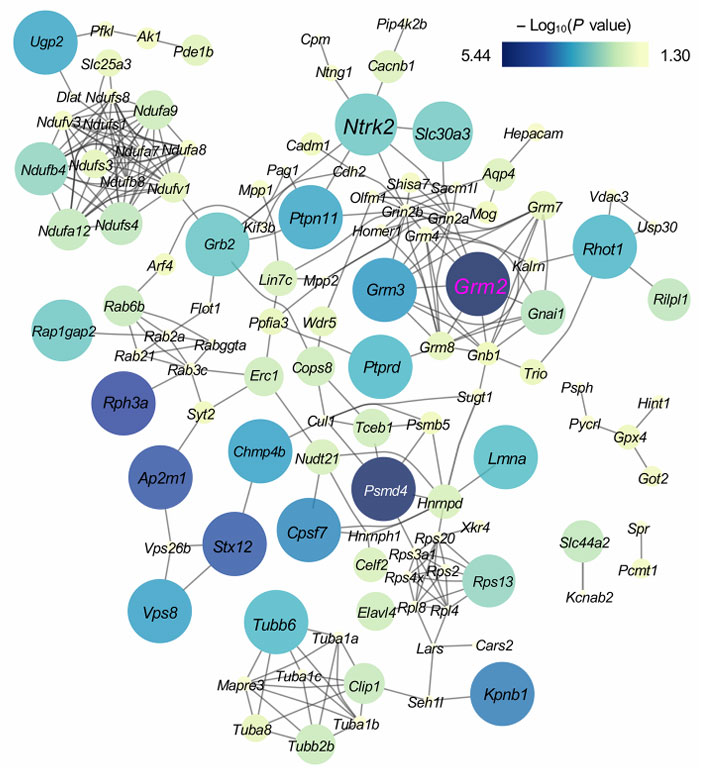
通过纳米抗体亲和纯化-质谱联用技术,研究团队鉴定出149个与mGlu2特异性结合的蛋白。其中mGlu2自身是富集度最显著的蛋白。值得注意的是,同家族的mGlu3/4/7/8受体也在其中,证实了mGlu受体家族间的异源聚合现象。此外,mGlu2偶联的经典蛋白Gαᵢ₁和 Gβγ也被成功捕获,验证了该方法的可靠性。通过STRING数据库分析这些互作蛋白的关联作用时发现,TrkB(神经营养因子受体/NTRK2)的富集程度位居前列,这一发现意义重大,这是因为TrkB在精神分裂症患者脑中表达显著降低,且与疾病病理机制密切相关。
图1:与mGlu2特异性结合的蛋白网络
解密mGlu2与TrkB之间的分子关系
为确认mGlu2与TrkB的相互作用,研究人员采用了共免疫沉淀+Western blot、细胞实验、PLA实验及BRET实验的多层验证策略。
共免疫沉淀实验显示,TrkB仅与mGlu₂结合,而不与高度同源的mGlu3结合。PLA实验进一步证实,在共表达TrkB和Flag-mGlu2的HEK293细胞中可见明显荧光信号,而TrkB与Flag-mGlu3共表达时无信号。在小鼠脑内,嗅球、前额叶皮层、齿状回和小脑等共表达区域均检测到mGlu2与TrkB的PLA信号,而mGlu2基因敲除小鼠中的信号显著降低。
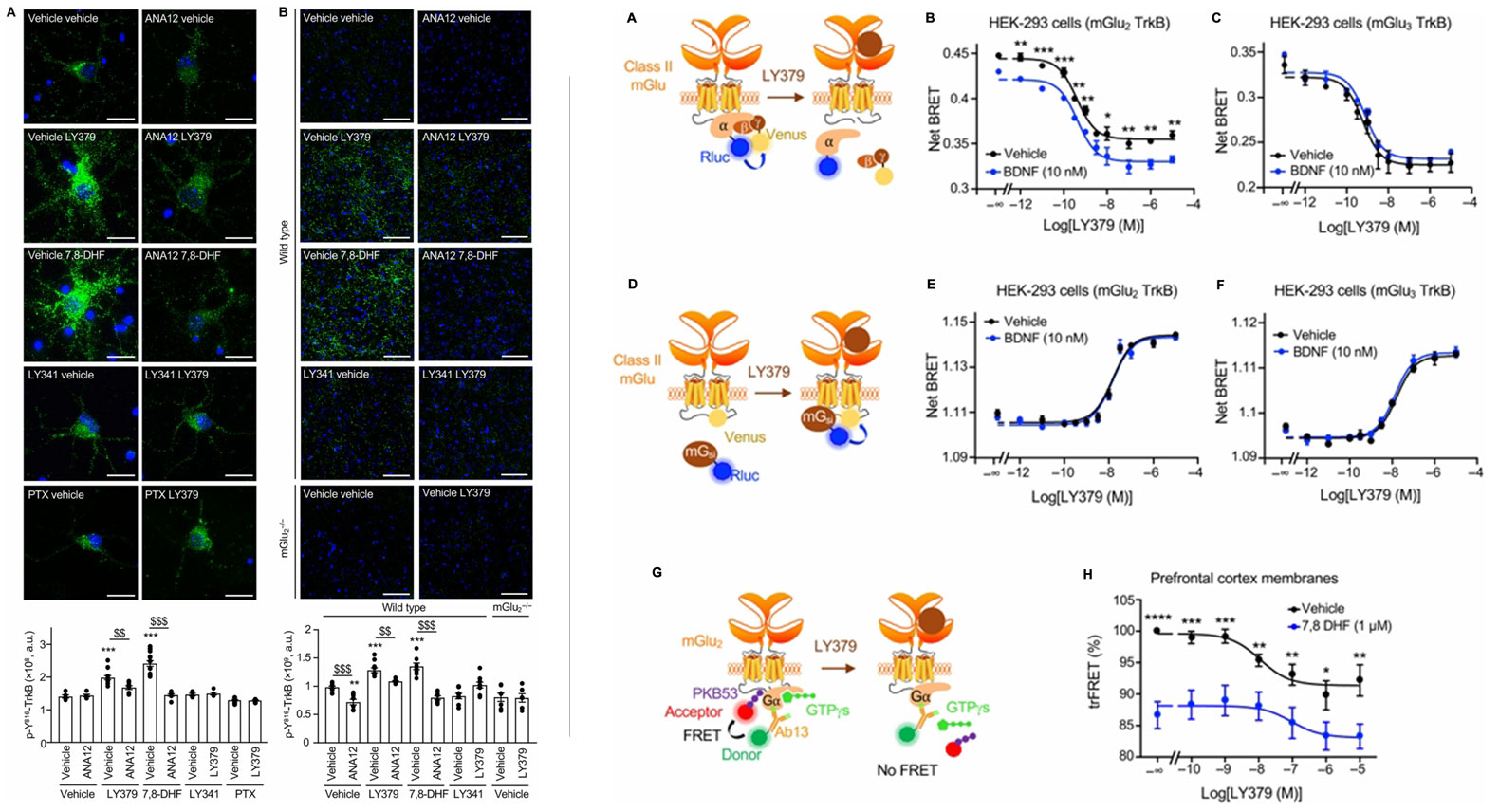
BRET实验提供了更深入的机制证据。TrkB与mGlu2的BRET信号随受体表达比例呈双曲线增长,而与mGlu3的信号接近阴性对照。值得注意的是,当mGlu2的c端替换为mGlu3的c端后,相互作用消失,证实mGlu2的c端是结合TrkB的关键结构域。
更重要的是,这种相互作用具有动态性:mGlu2激动剂LY379268或TrkB激动剂7,8-DHF处理可增强结合,而mGlu2拮抗剂LY341495则减弱结合,表明两者的相互作用依赖于各自的激活状态。
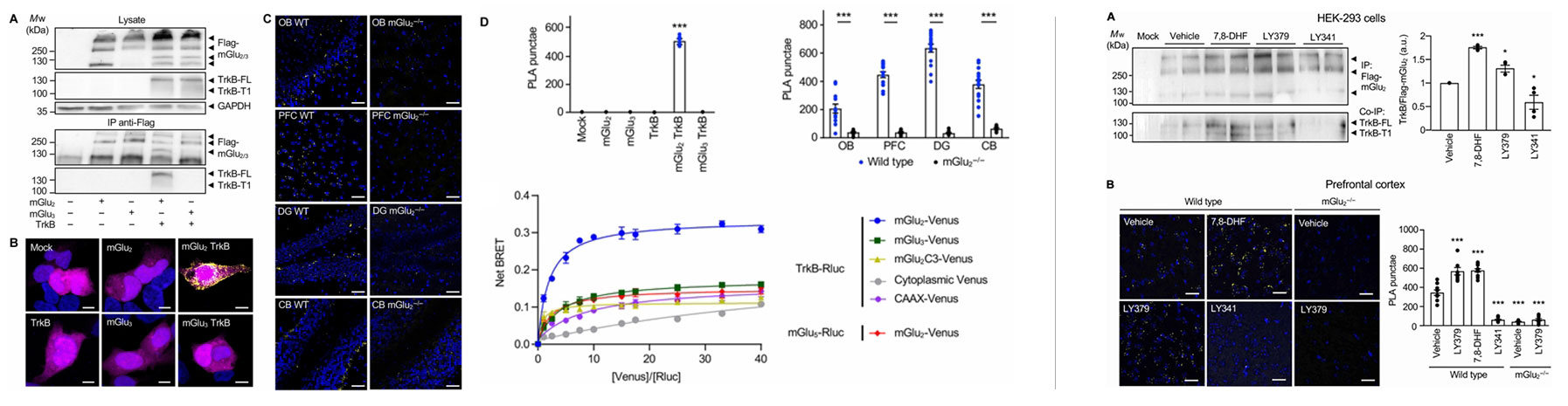
图2:mGlu2-TrkB相互作用机制
解析mGlu2与TrkB双向调控的“信号密码”
为探究mGlu2与TrkB的功能关联,研究团队分别对这两个受体的互相调控机制开展实验。
实验结果显示,mGlu2激活可快速诱导TrkB的Tyr816磷酸化:在原代皮质神经元中,LY379268处理2分钟即可检测到磷酸化增加,10分钟达峰值,且呈浓度依赖性。这一过程不依赖BDNF,且不受BDNF中和抗体阻断,但可被mGlu2拮抗剂LY341495、TrkB拮抗剂ANA12或Gi/o蛋白抑制剂PTX阻断,证实mGlu₂通过Gi/o蛋白直接激活TrkB13。在小鼠前额叶皮层(PFC)中,注射LY379268(10mg/kg)也能诱导TrkB磷酸化,且在mGlu2基因敲除的小鼠中完全消失。
相反,TrkB激活可增强mGlu2的信号传导。BDNF或7,8-DHF处理能显著增强LY379268诱导的Go蛋白解离,且不影响mGlu2对激动剂的效能。trFRET实验进一步证实,在小鼠PFC膜制备中,7,8-DHF预处理可增强LY379268诱导的Gαᵢ激活。这种增强作用仅针对mGlu₂,对mGlu₃无影响。
图3:mGlu2-TrkB双向调控机制
验证行为学效应:TrkB是mGlu2抗精神病作用的关键
为了验证mGlu2激动剂、TrkB激动剂在单独处理以及联合拮抗剂处理时的效果,研究团队采用苯环利定(PCP)诱导的精神分裂症小鼠模型中进行对照实验。
实验结果显示,mGlu2激动剂LY379268或TrkB激动剂7,8-DHF单独使用均能改善认知缺陷和兴趣丧失等症状,使行为指标恢复至正常水平。更关键的是TrkB拮抗剂ANA12能完全阻断LY379268的治疗效果,而mGlu2拮抗剂LY341495也能阻断7,8-DHF的作用。这一交叉阻断现象证实mGlu2与TrkB的功能耦合是抗精神分裂作用的核心机制,缺少任何一方的参与,药物均无法发挥疗效。
——“这就像两个舞者必须携手才能完成表演,”第一作者Clémentine Philibert解释,“阻断任何一方,整个治疗效应就会瓦解。”
纳米抗体驱动下的药物开发逻辑
该研究通过纳米抗体技术的精准应用,不仅揭示了mGlu2与TrkB相互作用的分子机制,更为精神疾病治疗带来了多维度的积极影响。现有抗精神病药物的局限性部分源于对疾病核心机制的理解不足,例如常用非典型抗精神病药物(如氯氮平)会抑制mGlu2-TrkB复合物的形成,这可能与其疗效局限相关。
此外,这种机制还拓展到抑郁症、癫痫以及神经退行性疾病的药物开发策略当中。如阿尔茨海默症患者同样存在TrkB信号受损的情况,mGlu2-TrkB轴可能成为有效的干预靶点。有临床前研究提示mGlu2的调节异常也会参与癫痫的发生。
纳米抗体的价值远不止于作为研究工具,其应用已拓展至抗体药物研发、体外诊断、工业与农业检测等领域,而如今,其独特性质正催生新型疗法。科学突破往往始于工具的革新,正如显微镜开启微生物学,纳米抗体正为我们打开生命宇宙的新维度。