吸入性脂质纳米颗粒的设计与改造
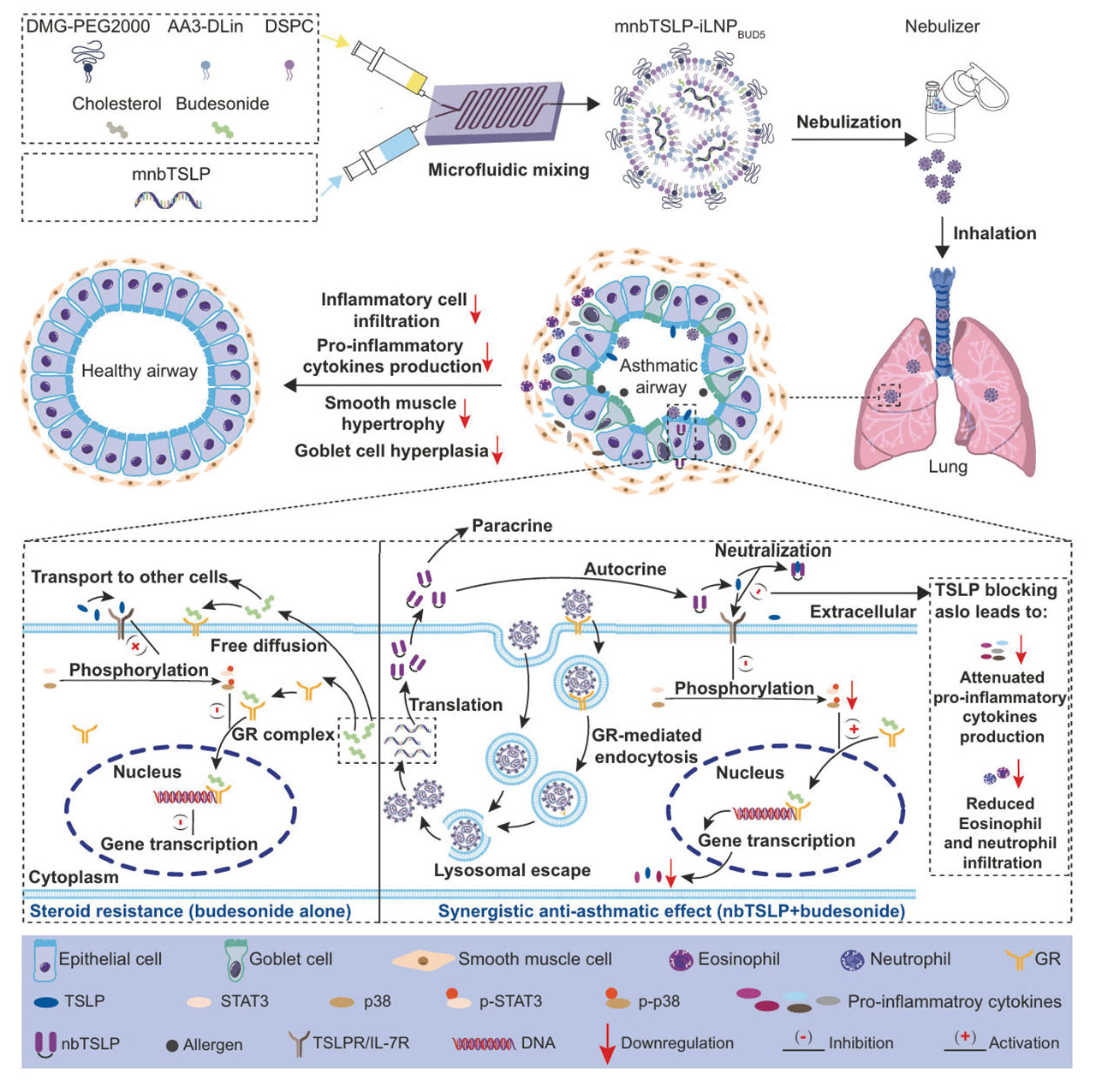
为突破类固醇抵抗困境,研究团队设计出一种具有双重功能的吸入性脂质纳米颗粒(iLNP),这种复合型iLNP以脂质双分子层(bilayer)为基础骨架,核心区域包裹着具有特定功能的mRNA。
针对基础骨架的改造,研究团队以胆固醇为基础,并用0%、5%、9.5%、14%及19%五个不同比例的布地奈德部分替代胆固醇,通过微流控技术制备不同配方的脂质颗粒,并评估其雾化后的稳定性、转染效率和结构完整性。测试结果显示,含5%布地奈德的iLNP表现最优:雾化后粒径、zeta电位以及多分散指数几乎无变化,包封率仅下降 2%,显著优于其他比例的配方。且该配方的转染效率有显著提升:在支气管上皮细胞BEAS-2B中,EGFP阳性细胞比例高达72%,是0%布地奈德组的1.5倍。进一步研究发现,布地奈德可通过GR介导的内吞作用促进iLNP进入细胞(该过程可被 GR 拮抗剂米非司酮阻断)。结果证明,在该载体骨架中,布地奈德不仅是治疗药物,同时也作为了iLNP的“结构助剂”,解决了传统脂质颗粒雾化后易破裂、转染效率低的难题。
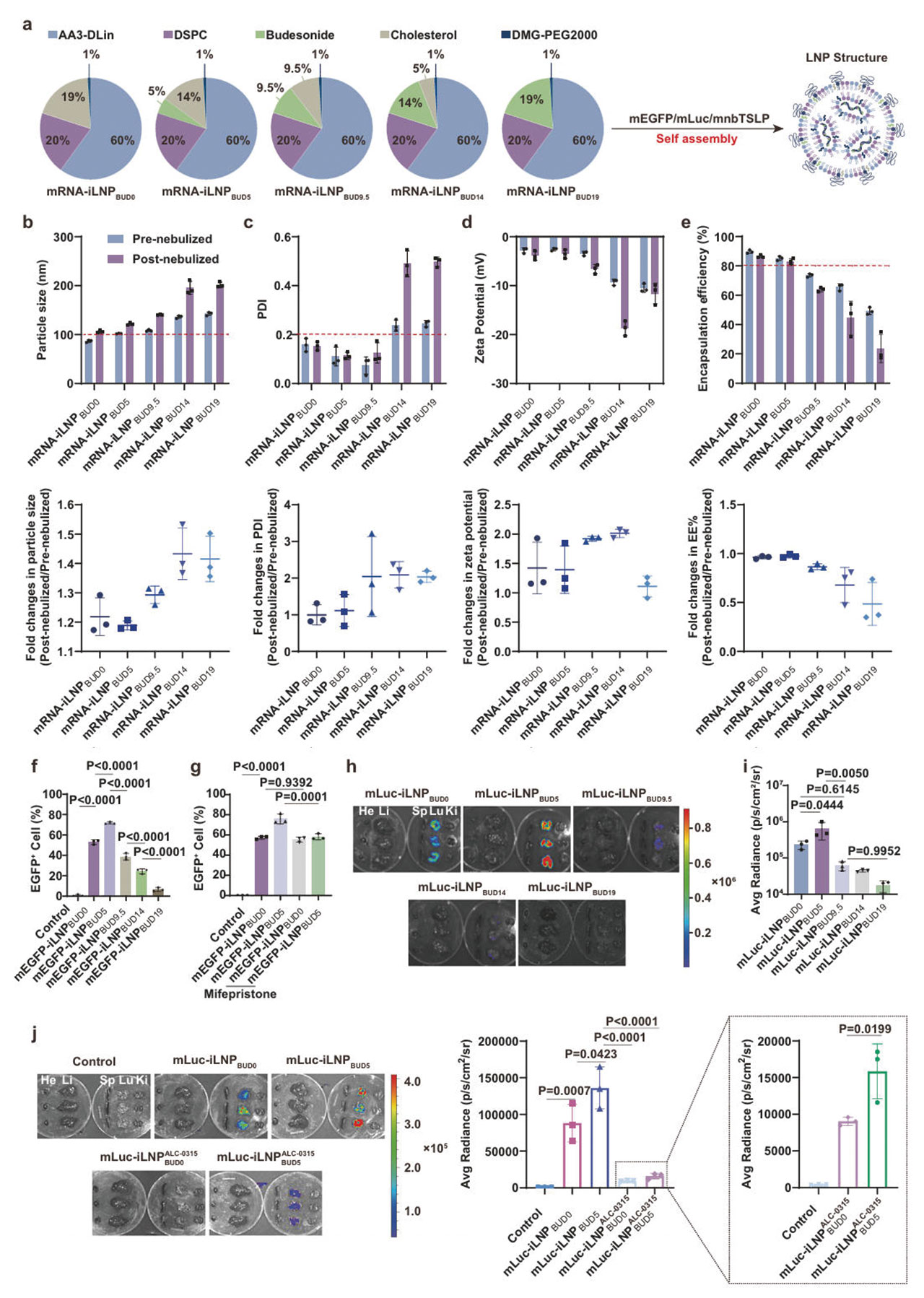
图1:吸入性脂质纳米颗粒的骨架改造
为了阻断TSLP信号通路并恢复类固醇敏感性,研究团队设计了一种名为mnbTSLP的可编码抗TSLP纳米抗体的mRNA。这个mRNA的序列包含:5’帽结构、非翻译区(UTR)、引导纳米抗体分泌到细胞外的编码分泌肽、增强与TSLP的结合的双价VHH域及检测标签Flag-Tag和His-Tag。在完成mRNA的序列设计后,研究人员将其包裹进5%布地奈德的iLNP骨架中形成最终的复合型iLNP,并命名为mnbTSLP-iLNPBUD5。
测试结果显示,体外转录的mnbTSLP经iLNPBUD5递送后,在16HBE细胞中可成功表达的35kDa的抗TSLP纳米抗体,该纳米抗体可以分泌到细胞外,并能与TSLP特异性结合,结合亲和力达162.1 nM,有效阻断了TSLP与受体(TSLPR/IL-7R)结合,从而减少了p38 MAPK和STAT3炎症信号通路激活,从上游遏制炎症反应的发生和发展。同时,研究人员发现iLNPBUD5可以有效降低mRNA的降解速度,且转染后可持续分泌抗TSLP纳米抗体长达72小时。
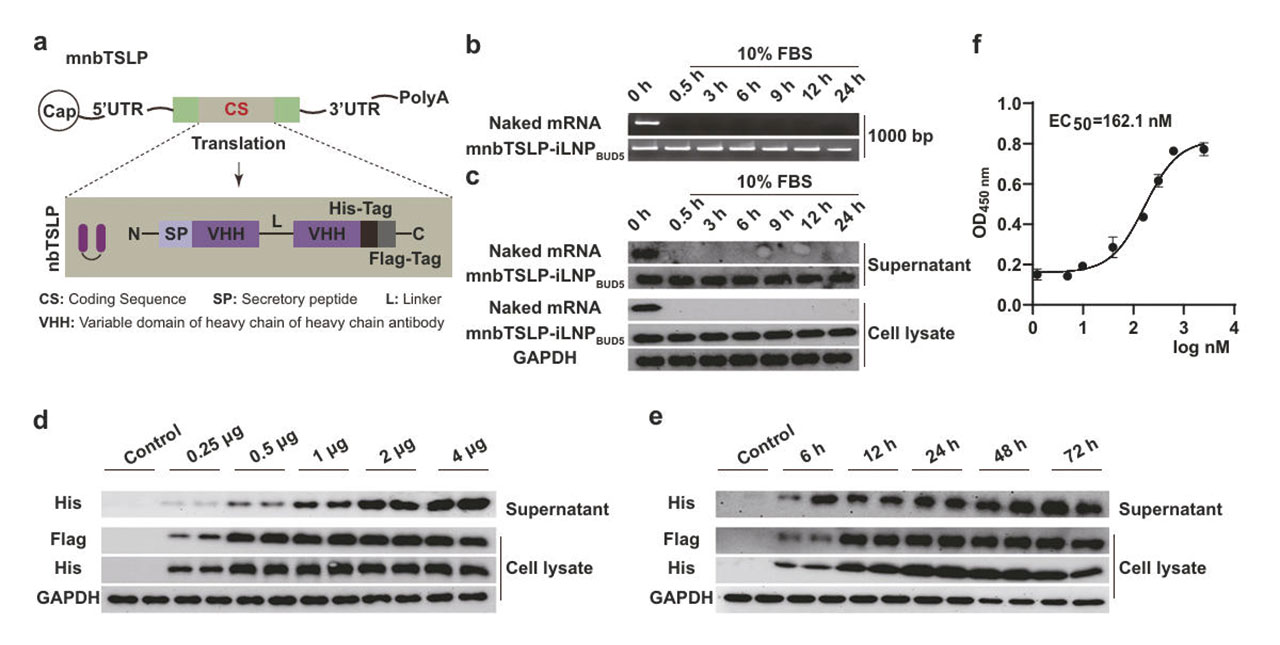
图2:mnbTSLP-iLNPBUD5的制备
协同抗炎作用的机制验证
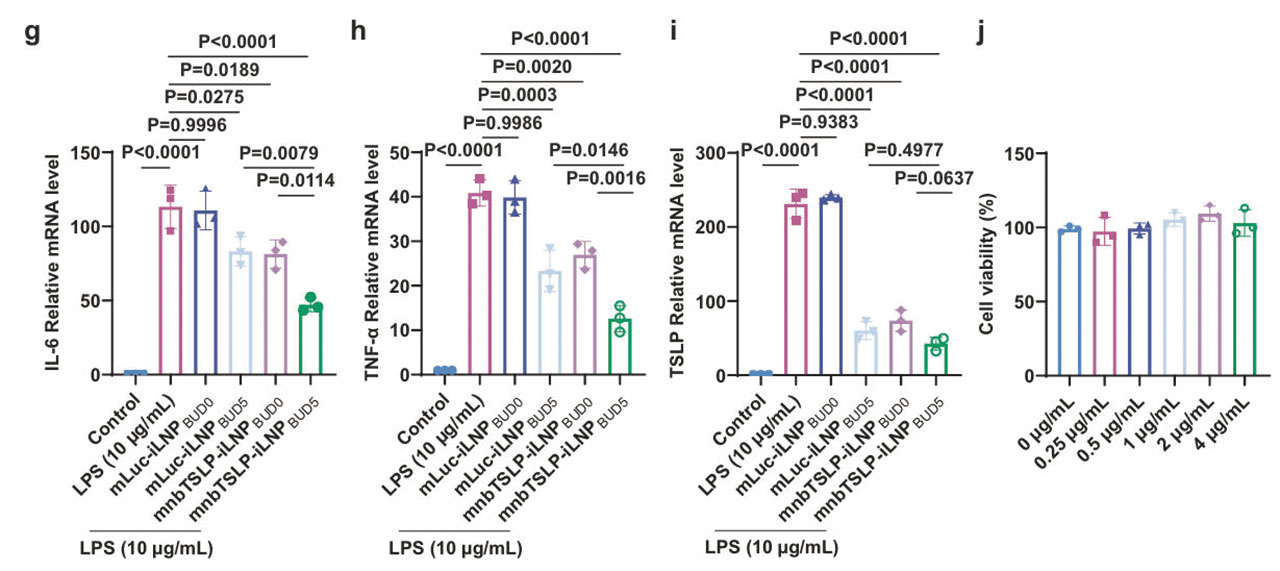
为了确认“纳米抗体+mRNA+布地奈德”三者协同抗炎的作用机制,研究团队用脂多糖(LPS)诱导16HBE细胞建立炎症模型,并分别给予mnbTSLP-iLNPBUD5、布地奈德及mnbTSLP进行炎症因子水平的测试。
实验结果显示,纳米抗体可有效抑制p38 MAPK和STAT3炎症信号通路的激活,由于这两个炎症信号通路被阻断后使得糖皮质激素受体(GR)的磷酸化大幅减少,反而恢复了GR与布地奈德的结合能力,使GR-布地奈德的复合物能够顺利进入细胞核,重新激活抗炎基因的转录,恢复类固醇的敏感性,增强其抗炎作用。
图3:mnbTSLP-iLNPBUD5的作用机制
在实验数据上,由于mnbTSLP-iLNPBUD5的骨架保护作用,该组的IL-6、TNF-α和TSLP mRNA水平分别降低了78%、65%和52%,显著优于对比组。
图4:mnbTSLP-iLNPBUD5的体外验证
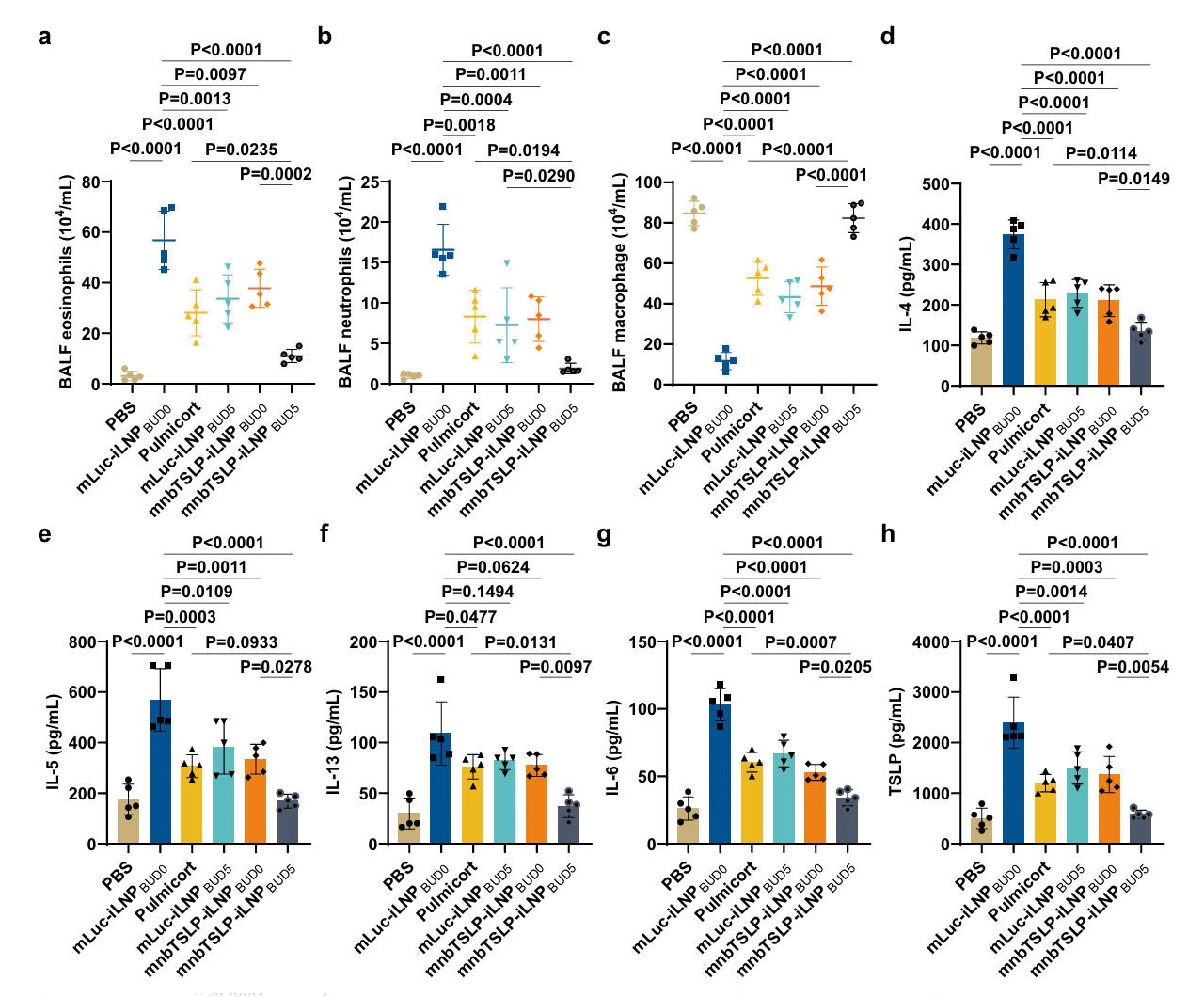
为确认mnbTSLP-iLNPBUD5的体内治疗效果,研究团队建立了经卵清蛋白(OVA) 致敏和激发建立急性哮喘小鼠模型,并分别让小鼠吸入mnbTSLP-iLNPBUD5、布地奈德及mnbTSLP以评估气道炎症和重塑指标。结果显示,经mnbTSLP-iLNPBUD5治疗的小鼠气道壁厚度从182μm降低至66μm,几乎接近健康小鼠对照组,炎症细胞浸润从36%降低至5%,黏液分泌和胶原沉积分别减少了77%和79%。其次,小鼠支气管肺泡灌洗液(BALF)中的嗜酸性粒细胞和中性粒细胞数量下降90%,IL-13、TSLP等细胞因子水平降低80%。
图5:mnbTSLP-iLNPBUD5减轻急性哮喘模型小鼠的气道损伤
图6:mnbTSLP-iLNPBUD5改善重症小鼠的气道炎症及肺功能
为了进一步确认mnbTSLP-iLNPBUD5对类固醇抵抗的治疗作用,研究团队通过OVA反复刺激,并联合TSLP注射建立了类固醇抵抗的哮喘小鼠模型。然后分别给予mnbTSLP-iLNPBUD5、布地奈德及Tezepelumab进行测试对比。
结果显示,布地奈德组小鼠的气道高反应性(AHR)无改善,阻力持续升高,为健康组的3倍;Tezepelumab组虽展现出一定的疗效,然而该组小鼠的气道阻力仍呈现出适度增加的情况,气道炎症和重塑指标层面的疗效仍不如mnbTSLP-iLNPBUD5组的小鼠水平。仅有经mnbTSLP-iLNPBUD5治疗的小鼠在甲胆碱刺激下气道阻力保持稳定,且该组小鼠肺部p38 MAPK和STAT3磷酸化水平降低至健康小鼠对照组的1.2倍,气道重塑指标显著改善,接近健康小鼠。
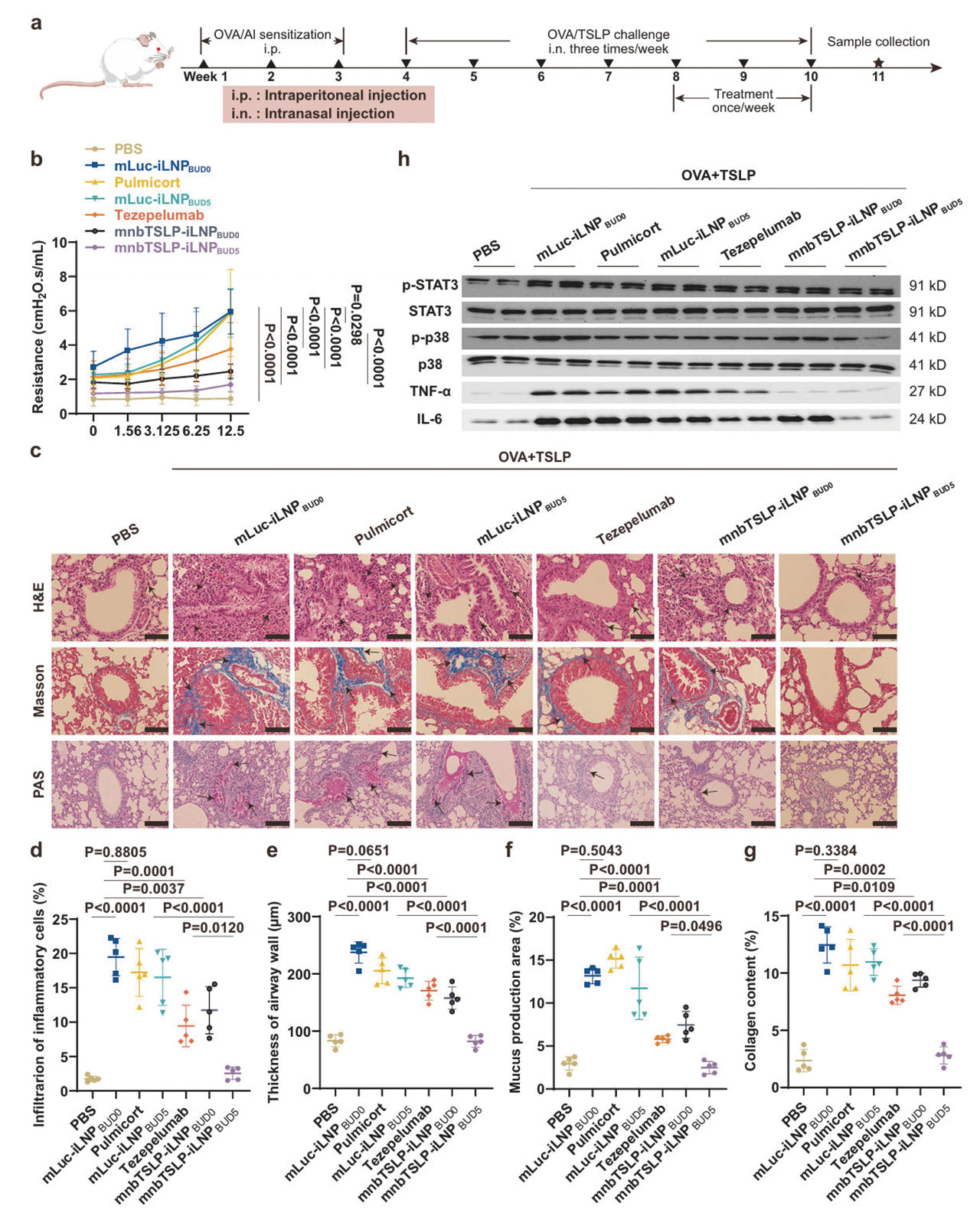
图7:mnbTSLP-iLNPBUD5在类固醇抵抗哮喘小鼠模型中的协同效应
三者结合的突破性策略
该研究利用吸入性脂质纳米颗粒(iLNP)共递送编码抗TSLP纳米抗体的mRNA与布地奈德进入肺部后,以用纳米抗体阻断 TSLP上游信号并让布地奈德重新发挥作用,首次证实纳米抗体可“解锁”类固醇抵抗,恢复布地奈德的抗炎活性,二者协同作用强于单一疗法。且mnbTSLP-iLNPBUD5中所使用的布地奈德含量仅为临床用量的1/3,却能达到更优秀的效果,不仅能有效降低类固醇抵抗的发生概率,同时也能减少患者长期使用布地奈德而导致的骨质疏松和血糖升高等副作用。形成了“1+1+1远大于3”的协同效应。
同时,该策略可通过替换靶点拓展至其他疾病领域。例如,针对同样存在气道炎症和类固醇抵抗的慢阻肺(COPD)。或根据疾病靶点快速替换mRNA序列,编码相应的纳米抗体,并利用iLNP来递送抗TGF-β纳米抗体来抑制肺纤维化进程,或递送抗IL-33纳米抗体达成过敏性肺炎的治疗策略。

纳博生命现拥有覆盖抗体开发到抗体发现,再到抗体工程的全链路技术平台。其中包括噬菌体展示、大肠杆菌展示、哺乳动物细胞展示等筛选平台,膜蛋白制备及mRNA免疫平台。通过多平台的交叉互补为药企及科研院所提供灵活的抗体发现及改造服务,助力药物试剂的研发。
纳博生命专注于纳米抗体开发、改造与应用,拥有符合实验动物标准的羊驼繁育基地与独立实验基地。致力于构建产、学、研一体化的实验公共服务平台。希望能为广大生物科研机构、医药研发企业和创新团队提供更专业、性价比更高的实验服务。更多服务内容,请关注纳博生命公众号或拨打官方电话400-822-9180进行咨询!