由法国图卢兹植物科学研究实验室及光成像中心联合发表于Cell Press旗下植物科学领域期刊《Plant Communications》的研究提供了破解植物蛋白研究的技术困局的新方法。该研究成功验证了ALFA标签/ALFA纳米抗体系统在植物中的广泛适用性,实现了从亚细胞定位、蛋白互作分析到超分辨率成像、靶向降解的全场景应用。该技术尤其突破了拟南芥IRT1铁转运蛋白等难标记蛋白的研究瓶颈,为植物蛋白功能解析提供了多功能、高兼容性的创新工具,重塑了植物生物学研究范式。
ALFA 纳米抗体-荧光融合蛋白的植物表达体系构建
研究团队首先构建了适用于植物的ALFA纳米抗体表达系统。通过基因工程将拟南芥密码子优化的ALFA NB与mCitrine、mScarlet等荧光蛋白融合,置于UBI10启动子下。选择UBI10启动子是因其可实现温和组成型表达,避免了CaMV35S启动子常见的基因沉默问题。
转化拟南芥后,研究团队通过农杆菌介导的拟南芥转化法转化拟南芥,筛选获得单插入纯合T3株系。表型分析显示,转基因植物与野生型在根长、生长速率上无显著差异,证明ALFA NB-荧光蛋白无毒性。通过激光共聚焦显微镜(confocal microscopy)观察发现,荧光信号广泛分布于根尖、根毛、叶肉细胞等组织,且蛋白主要定位于细胞质和细胞核,为后续与靶蛋白结合奠定基础。
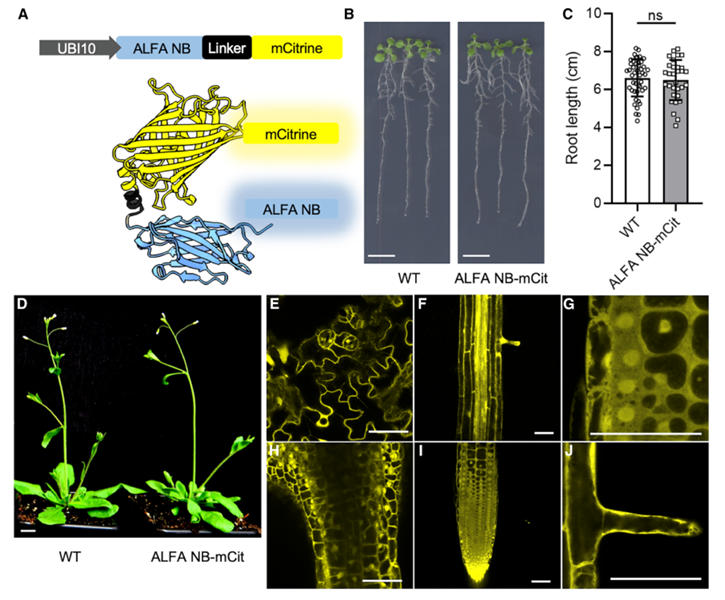
图1:ALFA 纳米抗体与荧光蛋白融合物在植物中的表达
亚细胞定位检测能力验证
为验证ALFA系统对不同亚细胞结构的标记能力,研究人员将ALFA标签融合至已知定位的marker蛋白,与ALFA NB-荧光蛋白共表达。
结果发现,质膜蛋白Lti6b-ALFA与ALFA NB-mCitrine共表达时,荧光从细胞质/核转移至质膜,与FM4-64共定位,证明可精准标记质膜蛋白。经渥曼青霉素处理后,蛋白在晚期内体积累,与已知内吞途径一致;ALFA标签融合的微管结合蛋白(MAP4)与ALFA NB-mScarlet共表达时,呈现典型微管丝状结构,且被安磺灵(oryzalin)破坏,验证了细胞骨架蛋白的标记有效性;而在细胞核与线粒体方面,携带核定位信号(NLS)的ALFA标签蛋白可引导ALFA NB-mScarlet进入细胞核,线粒体外膜蛋白OM64-ALFA与ALFA NB-mScarlet完全共定位,但由于纳米抗体无法穿透膜结构,因此系统无法检测内质网腔或线粒体内膜蛋白。
这些结果表明,ALFA纳米抗体系统可高效标记细胞质、细胞核、质膜、线粒体(外膜)等多种亚细胞结构的蛋白。
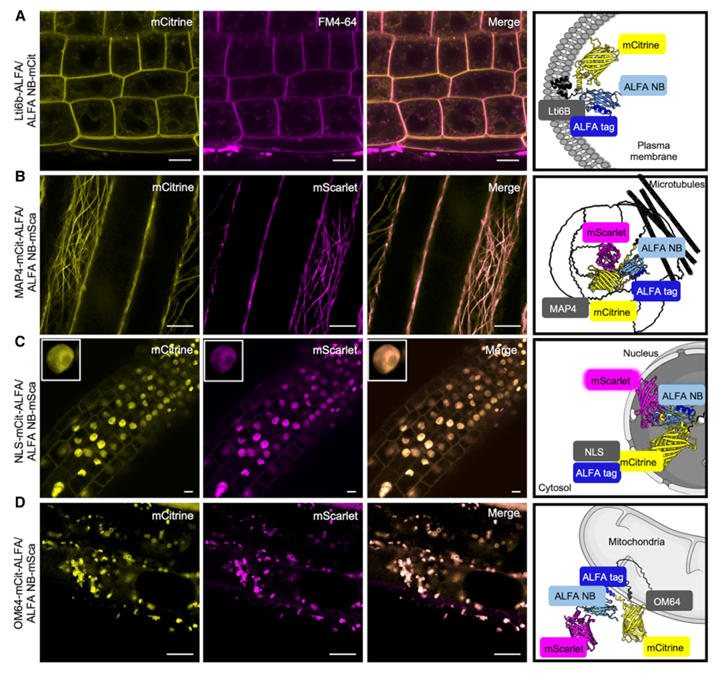
图2:通过与荧光蛋白融合的 ALFA 纳米抗体检测 ALFA 标记的蛋白质
难标记蛋白IRT1的研究突破:纳米抗体解锁功能解析
拟南芥IRT1是铁吸收的关键转运蛋白,因多跨膜区拓扑结构复杂,其N端和C端标记会破坏功能,传统荧光蛋白插入仅在特定胞外环有效,因此传统标记常导致功能失活。因此,研究团队利用ALFA纳米抗体系统实现了IRT1的功能标记与解析。
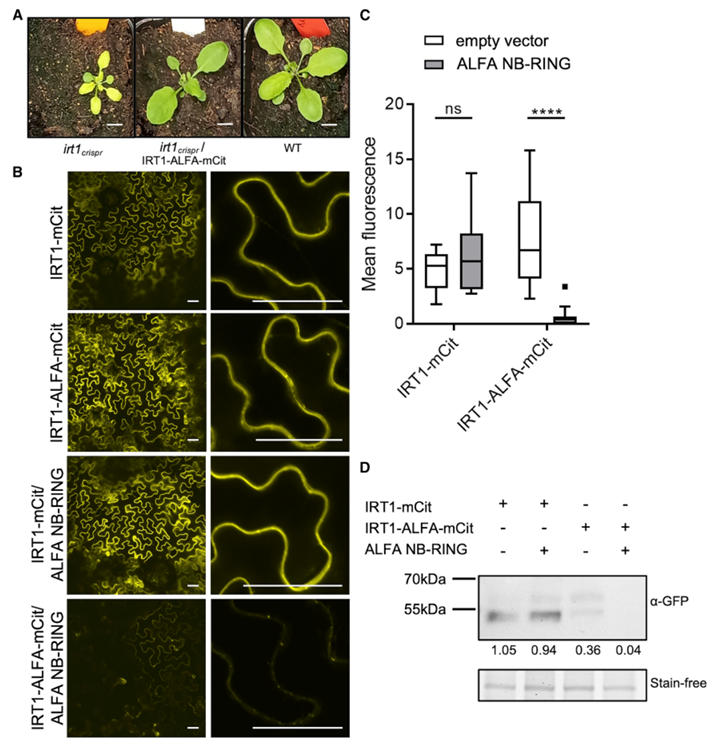
标签插入优化:研究人员在IRT1的4个潜在位点插入ALFA标签,发现插入胞外环1(P41-C42)和胞内环3(T148-S149)的融合蛋白可完全互补irt1突变体的缺铁性萎黄症。其中,胞内环3插入的IRT1-ALFA功能保留率达100%,而相同位点插入mCitrine则导致蛋白滞留内质网,凸显ALFA标签对复杂拓扑蛋白的兼容性.胞内环插入的IRT1-ALFA更利于ALFA NB结合,且性能优于同位置的荧光蛋白融合体。
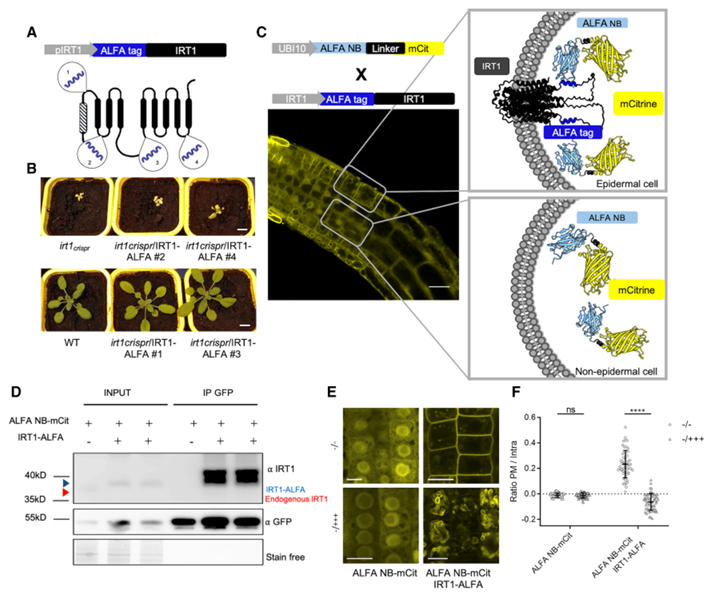
图3:ALFA 技术应用于IRT1成像和免疫共沉淀的概念验证
定位与动态调控:IRT1-ALFA在根表皮细胞质膜定位,与内源性IRT1表达模式一致。当植物处于非铁金属过量环境时,IRT1-ALFA会通过内吞作用转移至液泡膜,这一过程可通过ALFA NB-荧光蛋白清晰追踪,与已知的金属调控机制吻合。
相互作用验证:利用ALFA系统构建三元荧光互补(TriFC)体系,验证了IRT1与已知互作蛋白AHA2(H⁺-ATPase)和FRO2(铁还原酶)的结合,解决了传统双分子荧光互补(BiFC)中因信号肽切割导致的假阳性问题。
靶向降解:将ALFA NB与E3泛素连接酶的RING结构域融合,可特异性诱导IRT1-ALFA降解,而对无ALFA标签的IRT1无影响,证明该系统可用于蛋白功能的精准调控。
图4:靶向降解带有ALFA标签的IRT1蛋白
超分辨率成像:纳米抗体助力单分子追踪
传统超分辨显微技术依赖目标蛋白直接融合光转换荧光蛋白(如mEos3.2),但大尺寸标签(>25 kDa)易干扰蛋白功能,尤其对多跨膜蛋白失效。
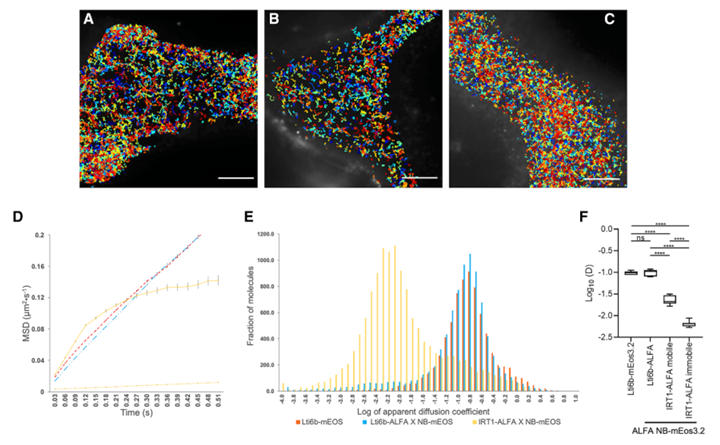
为实现植物蛋白的超分辨率追踪,研究团队创新性构建 “ALFA标签-纳米抗体-光转换荧光蛋白(mEos3.2)”三元体系来设计实验。实利采用间接标记策略,将ALFA标签插入靶蛋白(POI),由基因编码的ALFA纳米抗体携带mEos3.2实现特异性结合,再由sptPALM(单颗粒追踪光激活定位显微镜)进行动态追踪。为验证该体系的可靠性,研究以质膜蛋白Lti6b为参照,对比了直接融合(Lti6b-mEos3.2)与间接标记(Lti6b-ALFA+ALFA NB-mEos3.2)两种方式的效果。
结果显示,两种标记方式下的Lti6b扩散系数无显著差异,且两组均捕获到超过7400条有效轨迹,轨迹密度相当,这充分证明ALFA纳米抗体的介导不会干扰蛋白正常的动力学特征,验证了三元体系的技术有效性。
图5:通过 sptPALM对Lti6b-ALFA和IRT1-ALFA进行超分辨率成像
IRT1作为拟南芥铁吸收的关键转运蛋白,因多跨膜结构复杂和功能敏感性,传统荧光蛋白直接融合会导致其滞留于内质网或失去转运活性,无法开展正常研究。而ALFA纳米抗体分子体积小,ALFA标签仅17个氨基酸,且纳米抗体特异性极高,仅与ALFA标签结合,对靶蛋白功能影响几乎可以忽略不计。同时,ALFA纳米抗体系统采用“单次转基因”策略,只需构建一次ALFA标签融合蛋白,即可通过预制的ALFA纳米抗体株系实现多场景应用,大幅提升实验效率。
从科学意义来看,该研究首次在活体植物中实现了复杂跨膜蛋白的单分子动力学量化,不仅为IRT1这类难标记蛋白的功能研究提供了可行路径,更从技术层面为植物膜蛋白研究建立了新范式,推动植物生物学在单分子水平的研究迈向新阶段。而且,该研究不仅是验证了ALFA系统对于植物蛋白的研究革新,更是为作物重要性状解析提供了高效工具,为解析作物养分转运、抗逆应答等机制提供分子工具,推动精准设计育种。