新冠病毒并非孤立存在,它属于一个更大的病毒家族——沙贝科病毒(Sarbecovirus)。该家族成员众多,广泛存在于蝙蝠、穿山甲等动物体内,具有极高的遗传多样性和频繁的重组能力,多次跨物种传播给人类(如SARS-CoV和SARS-CoV-2),对全球公共卫生安全构成长期且严峻的威胁。然而,现有的疫苗和抗体药物大多靶向病毒刺突蛋白(Spike)上极易发生突变的受体结合域(RBD),导致其对新兴变异株的效果大打折扣。因此,开发能够靶向病毒保守区域、具有广谱中和活性的新一代抗病毒制剂,已成为科学界和产业界迫在眉睫的核心任务。由联合科研团队进行的这项研究诱导骆驼产生了“超级免疫”,并成功分离出 100 种泛冠状病毒纳米抗体(psNbs)。这些 psNbs 展现出强大的实力,对SARS-CoV、SARS-CoV-2 及其变体(包括奥密克戎变体)等多种sarbecovirus具有高效中和作用。通过对 13 种 psNbs的结构解析,揭示了它们靶向RBD上5类保守表位的特性,且中和效价与表位到受体结合位点(RBS)的距离密切相关。此外,研究团队还开发出可吸入双特异性psNb(PiN-31),为抗冠状病毒干预手段的拓展提供了新方向。
诱导“超级免疫”与抗体筛选
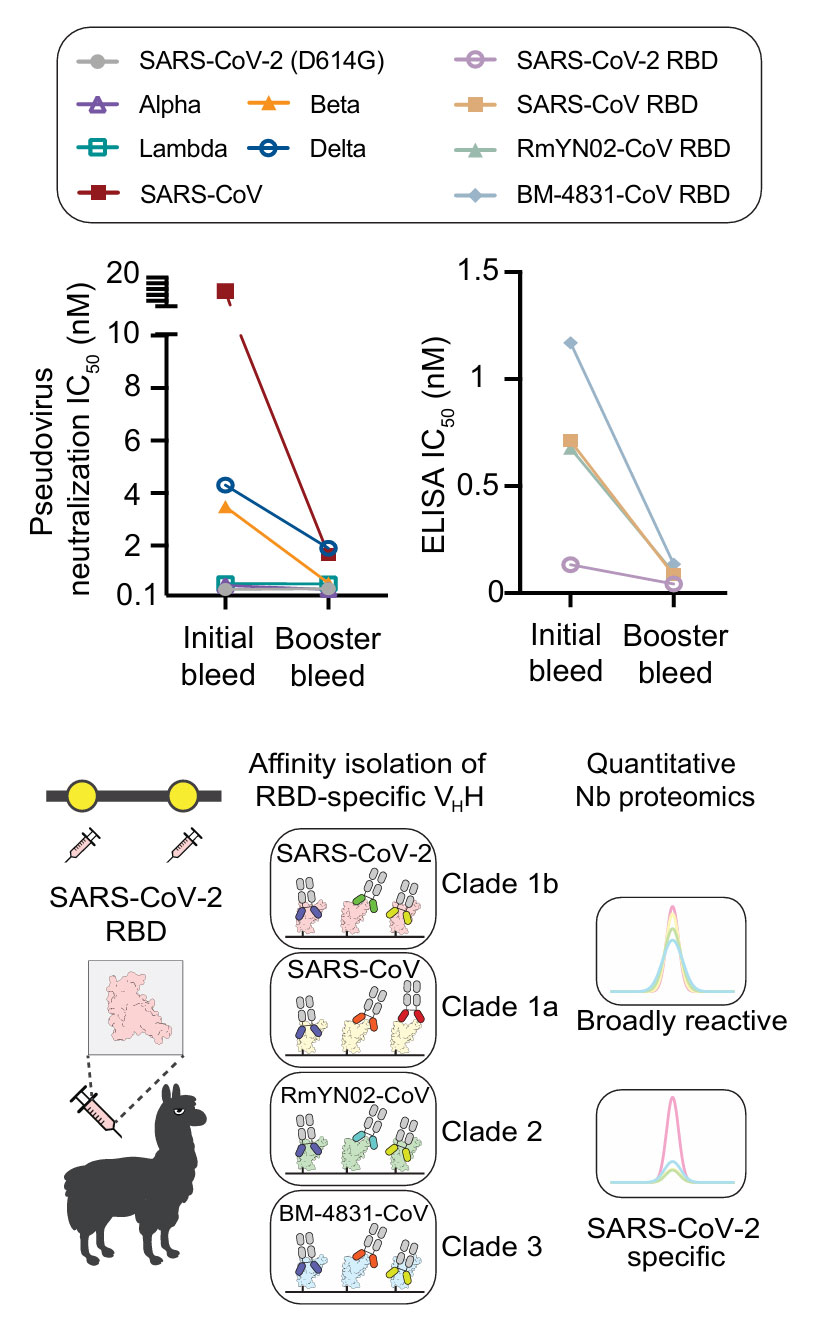
首先,研究人员选用羊驼作为免疫对象,对其进行了多达8次的SARS-CoV-2 RBD蛋白免疫。初始免疫使用0.2mg RBD与完全弗氏佐剂混合,后续进行7次加强免疫,每次使用0.1mg RBD。在经过多次加强免疫后,他们发现羊驼体内的免疫反应发生了质的飞跃:血清中的单域抗体(VHH)不仅对免疫原的亲和力更高,其结合和中和的广度也显著扩大,对Beta、Delta等变异株乃至SARS原始病毒都表现出更强的活性,这种现象被称为“超级免疫”(Superimmunity)。
随后,研究团队对产生“超级免疫”羊驼的血浆进行纯化,然后利用RBD亲和捕获技术,将与RBD结合的抗体初步筛选出来。接着,运用先进的整合蛋白质组学分析技术,并借助AugurLlama工具,从众多抗体中成功分离鉴定出100种高亲和力的psNbs。这些psNbs具有独特的优势,研究证实它们全部都能与不同支系(Clade)的沙贝科病毒RBD发生交叉反应,其中42%的psNbs能够同时结合全部4个病毒支系,证明了其卓越的广谱性,有7种psNbs除了能够与病毒RBD发生强交叉反应外,还不与人类全蛋白提取物发生交叉反应,这表明psNbs具有高度的特异性。
图1:羊驼免疫与psNbs的抗体发现
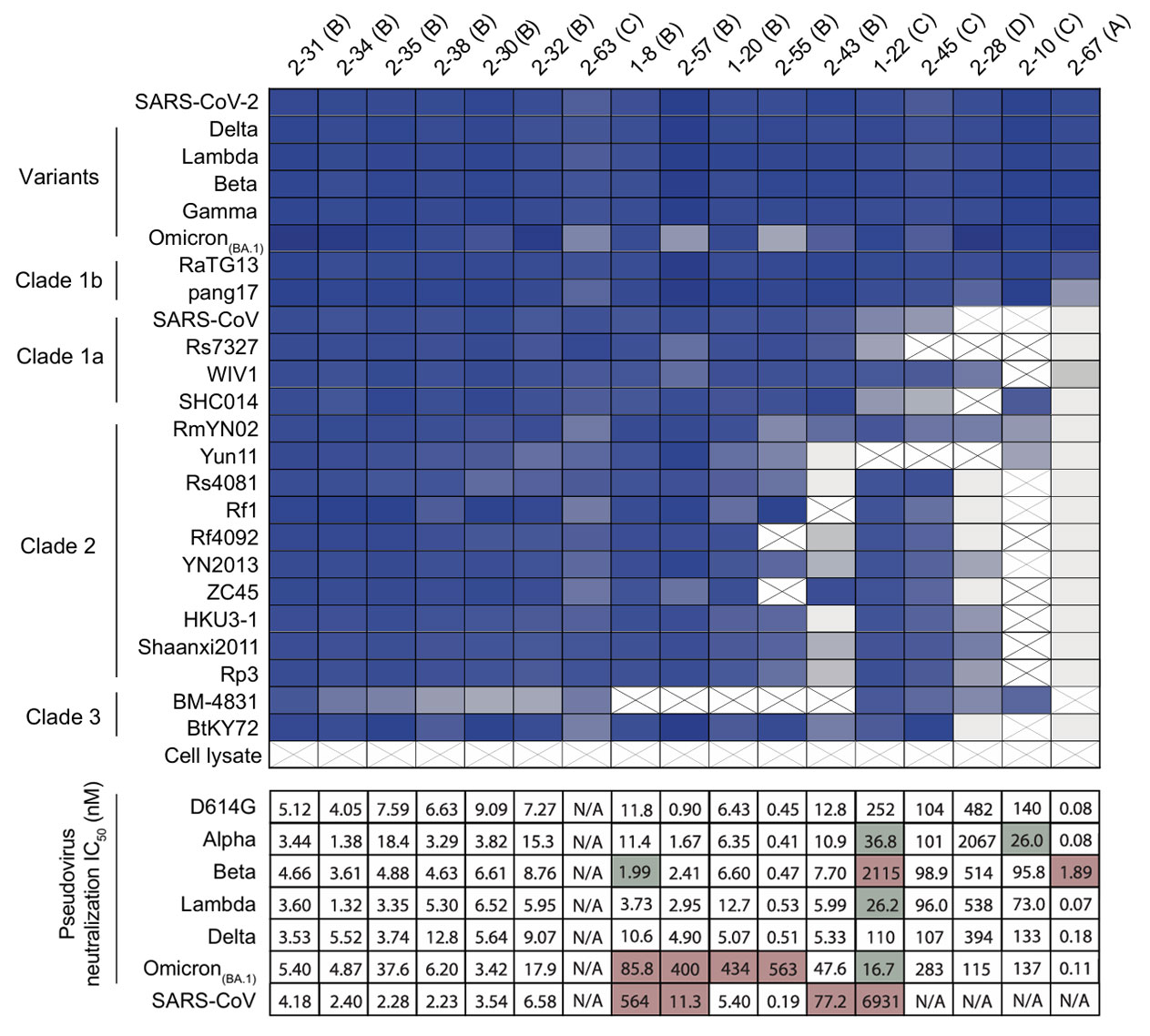
在进一步确认这100个psNbs功能的实验结果中发现,它们中的大部分都具有优异的中和能力。如下图所示,代表性psNbs对包括Omicron在内的多种假病毒都表现出纳摩尔甚至皮摩尔级别的中和效价,其效果远超许多传统抗体。
图2:代表性psNbs对不同变异株和沙贝科病毒的中和活性
结构生物学揭示psNbs表位特征与作用机制
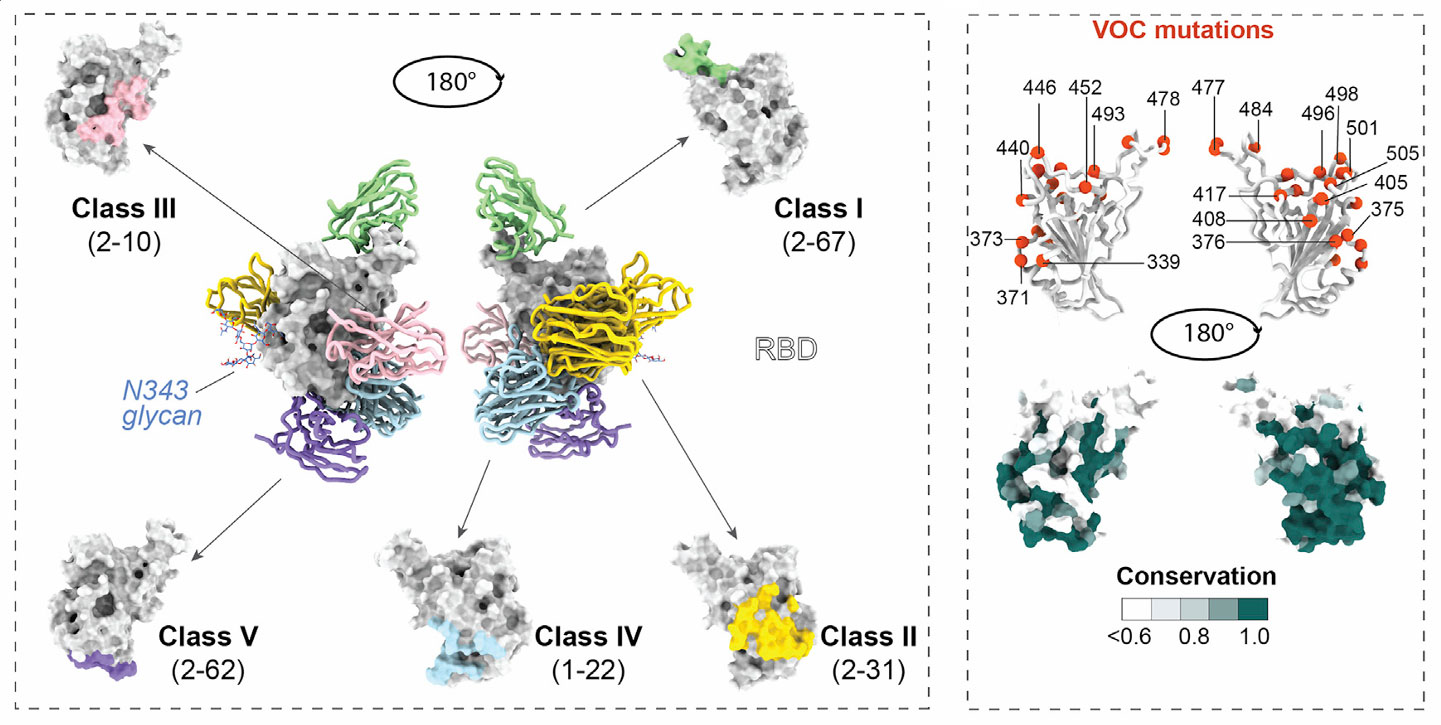
为深入了解psNbs的作用机制,研究团队利用冷冻电镜和X射线晶体学技术对psNbs进行结构解析。通过冷冻电镜,成功解析了11种psNbs与刺突/RBD复合物的结构,X射线晶体学则解析了2种psNbs-RBD结构。基于这些结构信息,研究人员将psNbs分为5类不同的表位。
- ClassI:以2-67为代表,靶向RBS(受体结合位点),其结合区域位于RBD凸起区域(aa472-490)。这类psNbs通过直接竞争ACE2的结合位点,阻断病毒与受体的结合,从而实现高效中和病毒,其效价最高,在所有psNbs中占比3%。
- ClassII:包括2-31、2-57等,结合于RBD非RBS区域,并进一步分为II(A)、II(B)亚类。它们共享疏水核心(aa377-386),通过空间位阻干扰ACE2与RBD的结合,在所有psNbs中占比最高。
- ClassIII:如2-10,结合于非RBS稀有表位,部分重叠Nb17表位,但转向更保守的小区域。这类psNbs通过破坏(destabilize)刺突结构来发挥中和作用,不过其中和效价相对较弱。
- ClassIV:以1-22、2-45为代表,靶向RBD-up构象特异性表位,结合于保守空腔(含D427、F464等)。它们虽然不直接竞争ACE2的结合,但能以中等效价中和病毒。
- ClassV:像2-62,结合于刺突内部保守表位,虽然能与RBD结合,但不与预融合刺突结合,几乎无有效中和作用,在所有psNbs中占比38%。
此外,psNbs靶向的表位具有高度保守性,含>75%RBD保守表面残基,且避开了变体关键突变位点,如aa371、373、375等。更为重要的是,中和效价与表位到RBS的距离呈现出极强的负相关(Pearson r=0.95),这一发现为后续开发更高效的抗病毒分子提供了关键的理论依据。
图3:5类psNbs在SARS-CoV-2 RBD上的结合表位分布
psNbs功能验证与双特异性psNb开发
研究人员通过ELISA实验检测了psNbs与24种RBD的结合能力。结果显示,多种psNbs表现出良好的结合活性,进一步验证了其广泛的结合谱。同时利用SPR技术,测定psNbs的结合动力学参数。例如,2-31对1b分支的K_D<1pM,表明其具有极高的亲和力。在中和实验中,采用假病毒中和实验覆盖奥密克戎等多种变体,以及空斑减少中和试验(PRNT)针对Munich株和Delta株进行测试。结果显示,psNbs对SARS-CoV-2及变体展现出强大的中和能力。如Class I psNb(如2-67)中和效价中位数达到1.4ng/mL;Class II psNb(如2-55)最低效价为7ng/mL。对于SARS-CoV,Class II psNbs同样表现出高效力,Class IV psNbs(如1-22)效价也能达到单位数微克/毫升。
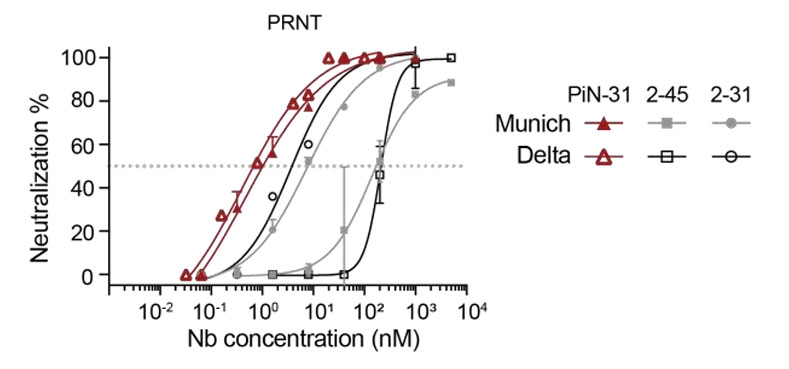
最后,研究团队将2-31(Class II(B))与2-45(Class IV)进行融合,构建出可吸入双特异性纳米抗体psNb(PiN-31)。这种双特异性分子覆盖了2类不同的保守表位,具有独特的优势。PRNT实验结果显示,PiN-31的中和效价高达0.4nM,较单体提升了1个数量级,展现出更强的中和效价。而且,psNbs本身稳定性高,可耐受气溶胶化且活性无损失,使得PiN-31适合采用吸入给药的方式,直接作用于呼吸道,为呼吸道传染病的防治提供了新的有效途径。
图4:双特异性纳米抗体PIN-31的效果示意图
匹兹堡大学联合研究团队开展的这项研究,不仅仅是一次技术上的突破,更是一次战略思维的革新。它告诉我们,与其被动地追逐不断变异的病毒,不如主动地利用纳米抗体等先进技术去靶向病毒的致命弱点。且该研究成果具有极其广阔的应用前景和巨大的市场价值,这些psNbs,尤其是双特异性或多价组合,可以为预防或治疗用途的药物及广谱疫苗提供有效的设计思路。