纳米抗体制备与特性优化
代谢型谷氨酸受体2(mGlu2)同源二聚体作为调节脑内谷氨酸能活性的关键靶点,已在精神分裂症等疾病的临床研究中被验证,但此前针对该靶点的药物因效果不佳或副作用问题失败。因此,研究团队专注于开发一种能穿透血脑屏障、精准靶向mGlu2,且具备半衰期长、治疗效能高的新型治疗性抗体。
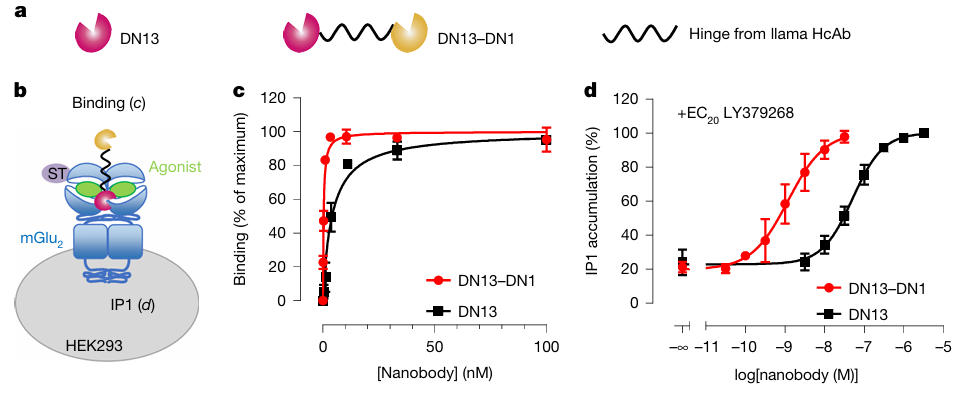
此前,团队已研发出纳米抗体DN13,它可特异性结合mGlu2受体并对其进行正向调节,具备靶向mGlu2的基础优势。为进一步提升其效能和脑部作用潜力,研究团队创新性地将DN13与另一个结合mGlu2但不激活它的纳米抗体DN1,通过特殊的连接子(Linker)连接起来,构建了双价双特异性纳米抗体DN13-DN1。
如下图所示,这种双价设计带来了巨大优势并在后续实验中得到验证。通过饱和结合实验与功能活性检测,结果显示:在激动剂LY379268存在下,DN13-DN1对mGlu2的表观亲和力(Kd=0.50nM)较单体DN13(Kd=4.10nM)提升10倍;其PAM效价(EC50=1.76nM)较DN13(EC50=101nM)提升近2个数量级,且仅特异性结合mGlu2同源二聚体,不与其他mGlu受体交叉反应,为后续实验奠定了高特异性与高效能的分子基础。
图1:DN13–DN1纳米抗体可增强受体激活
纳米抗体脑穿透性验证
为确认DN13-DN1能否通过外周给药进入脑内,团队采用腹腔注射方式,结合氚标记与免疫组化技术开展研究。将DN13-DN1标记为 [³H]DN13-DN1后腹腔注射,定量检测显示:给药后4小时,脑内放射性占给药剂量的0.08%,估算脑浓度达9.2nM(约 20*Kd);7天后脑内浓度仍维持1.5nM(约3*Kd),均高于有效作用浓度。
免疫组化结果进一步证实,给药24小时后,DN13-DN1在腹侧被盖区(VTA)、大脑皮层等mGlu2高表达区域特异性分布,而对照组(生理盐水注射)无阳性信号。放射自显影实验也观察到类似的脑区分布特征,明确证明DN13-DN1可穿透血脑屏障并在脑内特定区域富集留存。
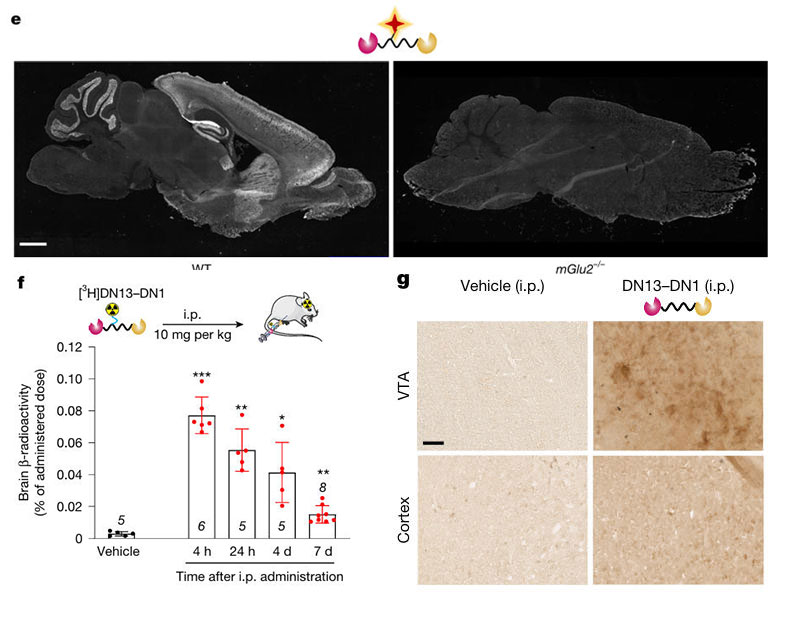
图2:DN13–DN1可穿透血脑屏障且具有长效性
动物模型的行为学改善治疗效果验证
为进一步确认DN13-DN1的治疗效果,研究团队选择了新生期PCP诱导模型(模拟精神分裂症)GluN1-KD遗传模型(模拟GRIN1障碍)这两种经典的NMDA受体功能低下相关小鼠模型进行验证。
新生期PCP诱导模型:
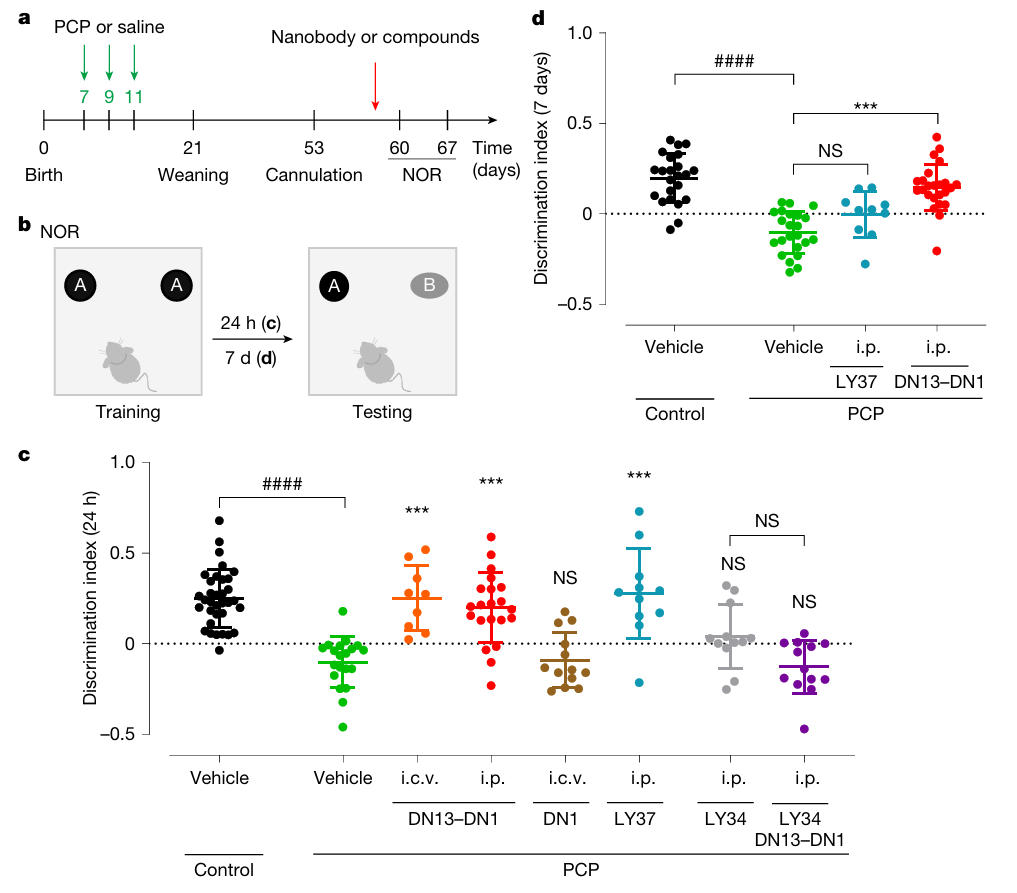
NMDA受体功能低下是精神分裂症的核心病理机制之一,因此研究团队通过在小鼠新生期(P7、P9、P11)皮下注射NMDA受体拮抗剂PCP,构建出具有精神分裂症样认知缺陷的小鼠模型。成年后,采用新物体识别(NOR)测试评估识别记忆,测试流程分为训练阶段与测试阶段,并分别设置24小时和7天的记忆保留期,以验证药物的短期与长期效果。结果显示:单次腹腔注射10mg/kg的DN13-DN1,在24小时后PCP模型鼠的识别记忆显著恢复,效果与mGlu2/3激动剂 LY379268(1mg/kg 腹腔注射)相当;作为对照,中性抗体DN1无改善作用,而mGlu2拮抗剂LY341495可完全阻断DN13-DN1的效果,证实其作用依赖mGlu2激活。关键的是,在7天保留期测试中,LY379268已无治疗效果,而DN13-DN1仍能有效改善识别记忆,凸显出长效治疗优势。
图3:DN13–DN1对新生期PCP诱导的精神分裂症小鼠具有显著治疗作用
GluN1-KD遗传模型:
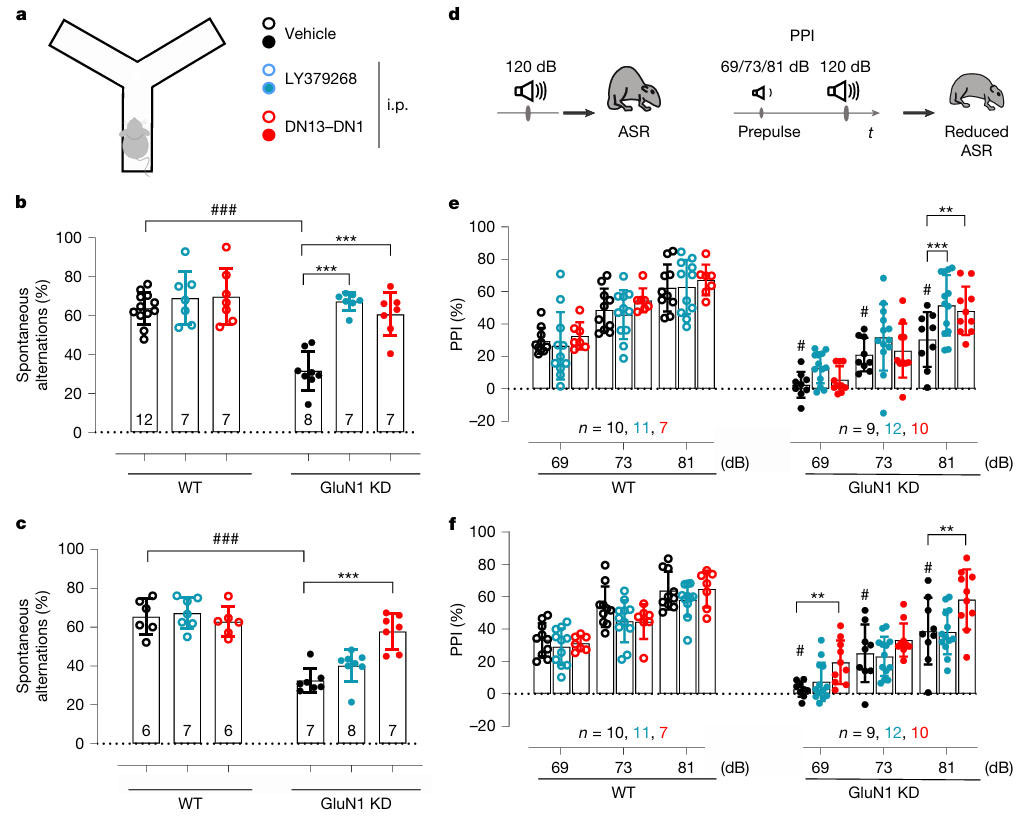
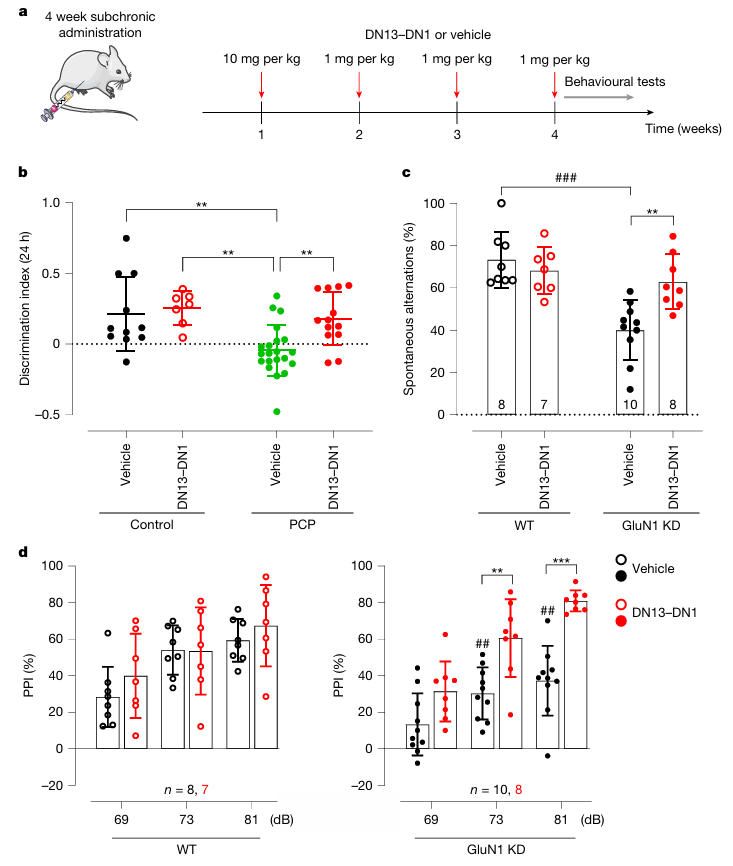
该模型通过降低GluN1亚基表达,导致NMDA受体功能部分缺失,模拟人类罕见病GRIN1障碍。团队采用Y迷宫测试评估工作记忆,前脉冲抑制(PPI)测试评估感觉运动门控。Y迷宫测试结果显示:单次腹腔注射20mg/kg DN13-DN1,3小时后GluN1-KD小鼠的工作记忆显著提升,与LY379268效果相当;7天后再次测试,DN13-DN1组仍维持改善效果,LY379268组则无明显作用。
PPI测试结果表明:给药3小时后,DN13-DN1可改善81dB前脉冲强度的PPI缺陷;7天后效果进一步增强,对69dB、81dB两种前脉冲强度均有改善作用,且不影响听觉惊跳反应(ASR),证明其可有效修复感觉运动门控功能。
图4:DN13–DN1可改善GluN1-KD小鼠的工作记忆和感觉门控
亚慢性治疗安全性评估及优势对比
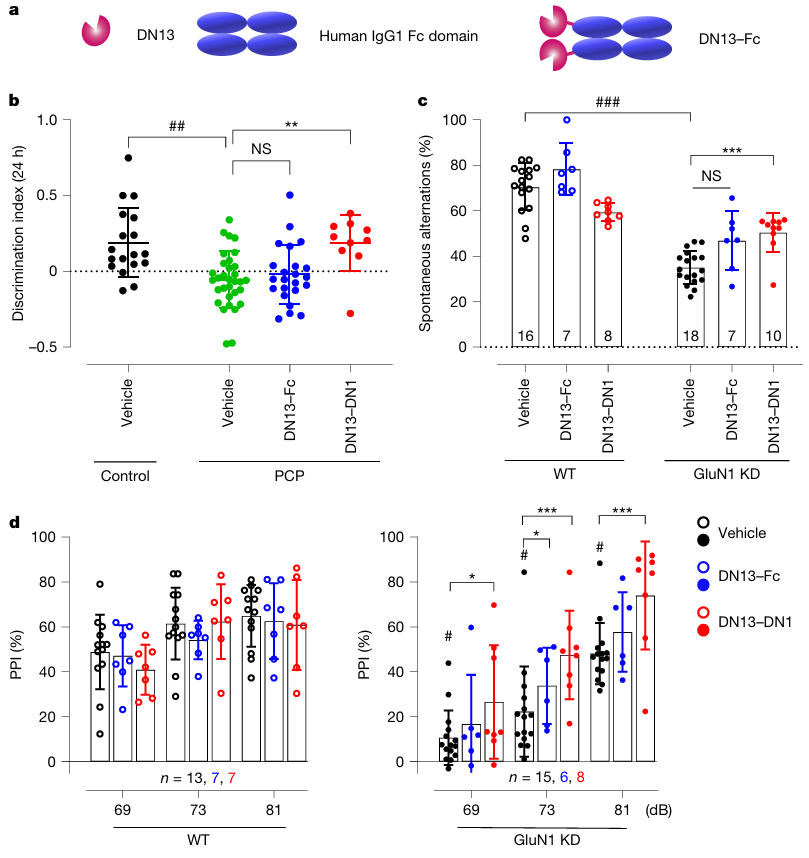
为模拟临床长期用药场景,团队设计亚慢性给药方案:初始腹腔注射10mg/kg DN13-DN1,后续每间隔1周注射 1mg/kg,共4次给药。结果显示:在两种模型中,亚慢性治疗均能稳定维持识别记忆、工作记忆与感觉运动门控的改善效果,且无性别差异,不影响小鼠体重。
安全性检测发现,DN13-DN1不改变脑内mGlu2受体表达,不影响小鼠运动协调、平衡与僵住行为;其含有的内毒素(LPS)浓度低于神经毒性阈值,进一步纯化后治疗效果无差异,排除了内毒素干扰,证实其安全性。
图5:DN13–DN1亚慢性给药方案可改善两种精神分裂症小鼠模型的行为缺陷
为凸显纳米抗体优势,团队将DN13-DN1与小分子药物LY379268、IgG类抗体DN13-Fc进行对比。结果显示:在长效性上,DN13-DN1单次给药效果维持7天,LY379268仅急性有效;在脑内作用上,DN13-Fc(80kDa)腹腔注射后无任何行为改善效果,而DN13-DN1因小尺寸具备更优的血脑屏障穿透性,证实纳米抗体在脑疾病治疗中的独特优势。
图6:DN13–Fc在两种精神分裂症小鼠模型中无急性行为效应
DN13-DN1的核心优势源于其独特的分子设计与作用机制。从结构上看,它仅15kDa的极小体积,使其能穿透血脑屏障并在脑内特定区域富集,这是传统IgG类抗体无法实现的;从特异性上看,它仅结合mGlu2同源二聚体,不与其他mGlu受体交叉反应,避免了脱靶副作用;从作用机制上看,作为阳性变构调节剂(PAM),它仅在内源性谷氨酸存在时增强mGlu2信号,既保留了生理信号的时空特性,又避免了受体过度激活导致的脱敏问题。此外,双价设计大幅提升了其对mGlu2的亲和力与效能,使其在脑内滞留时间长达7天,单次给药即可实现长效治疗,显著提高患者用药依从性。
这项研究成果不仅是纳米抗体技术在脑疾病治疗领域的重大突破,更是对于由NMDA受体功能低下引起的多种中枢神经系统疾病的治疗,特别是一些认知障碍阴性症状的精神分裂症,以及遗传性GRIN1障碍的治疗带来了革命性的治疗策略,为全球数百万患者带来新的希望。

武汉纳博生命科技有限公司是由武汉产业创新发展研究院牵头成立建设的纳米抗体产业平台。其总部位于武汉东湖新技术开发区武创院本部大楼,在武汉生物城精准医疗产业基地拥有占地面积达1400㎡的自主实验室,并在武汉左岭与黄冈团风分别建立了符合实验动物标准的羊驼实验基地与转运基地,目前基地在饲养的羊驼共600余头,可为科研机构及抗体药物研发企业提供“零免疫背景”保障的羊驼免疫服务。
纳博生命专注于纳米抗体开发、改造与应用,致力于构建产、学、研一体化的实验公共服务平台。现拥有从抗原制备(多肽、蛋白及RNA),到抗体发现和抗体工程,再到生物学功能验证/筛选的全链路技术平台。其中RNA抗原包括针对羊驼进行RNA结构和序列优化的RNA;抗体发现与抗体工程服务采用噬菌体展示、RNA以及哺乳动物细胞展示在内的多种技术路线。通过多平台的交叉互补为药企及科研院所提供灵活的抗体发现及改造服务,助力药物试剂的研发。
除纳米抗体天然文库外,纳博生命科技还推出了现货免疫库,帮助客户快速筛选符合需求的抗体分子。
联系方式:400-822-9180
联系邮箱:marketingdept@nanobodylife.com