研究背景
呼吸道病毒感染,如流感和COVID-19造成沉重的全球疾病负担与经济损失,病毒通过其表面糖蛋白与呼吸道上皮细胞受体结合启动感染,而上皮细胞分泌的凝胶状黏液构成第一道物理防线,能捕获并清除病毒;该黏液层的核心功能成分是黏蛋白(如MUC5AC和MUC5B),基因敲除实验证实黏蛋白缺失会导致病毒复制增强、病理损伤加重及死亡率升高,从而确立黏蛋白在黏膜防御中的关键作用。
纳米抗体是源自骆驼科动物重链抗体的单结构域抗原结合片段,与传统抗体相比具有体积小、易改造递送、且无Fc结构域(避免引发相关免疫反应)的特点;尽管已有针对流感与新冠病毒的中和性纳米抗体,但尚未有研究利用天然黏膜防御机制增强保护。
为此本研究开发了同时靶向病毒表面蛋白与黏蛋白的双特异性纳米抗体,通过增强病毒与黏液的相互作用以实现黏膜保护,并在小鼠与仓鼠模型中验证了其抗病毒与阻断传播的效果。
研究内容
纳米抗体的筛选与构建:
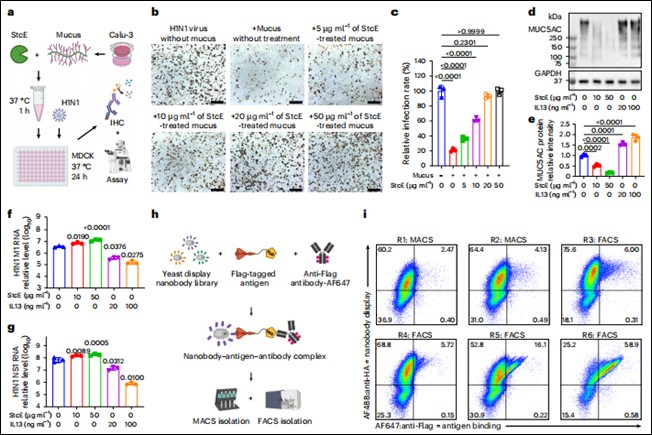
筛选:利用酵母表面展示技术,从一个包含超过5×10⁸个合成序列的文库中,快速筛选出针对人源MUC5AC粘液蛋白、鼠源Muc5ac蛋白、H1N1流感病毒血凝素(HA)蛋白以及SARS-CoV-2刺突(Spike)蛋白的特异性纳米抗体。(筛选验证结合效果见图1 h,i)
构建:通过头尾相连的方式,将病毒中和纳米抗体(如靶向H1N1 HA的Nb.I9,或靶向SARS-CoV-2 Spike的Nb.S13iD)与黏液结合纳米抗体(如靶向人MUC5AC的Nb.H17或靶向鼠Muc5ac的Nb.M6)融合,构建成双特异性纳米抗体(例如Nb.I9-M6, Nb.S13iD-M6)。
对部分SARS-CoV-2纳米抗体进行了易错PCR亲和力成熟,并构建了同源二聚体以增强中和效力。
体外实验验证:
粘液保护作用验证:使用Calu-3人肺上皮细胞(可分泌黏液)和MDCK细胞,通过StcE酶(降解粘液蛋白)和IL-13(刺激粘液分泌)处理,验证粘液层(尤其是MUC5AC蛋白)对H1N1病毒感染的物理屏障保护作用。(见图1b、d、f、g)
图1. 黏液层的保护作用不依赖于黏液蛋白
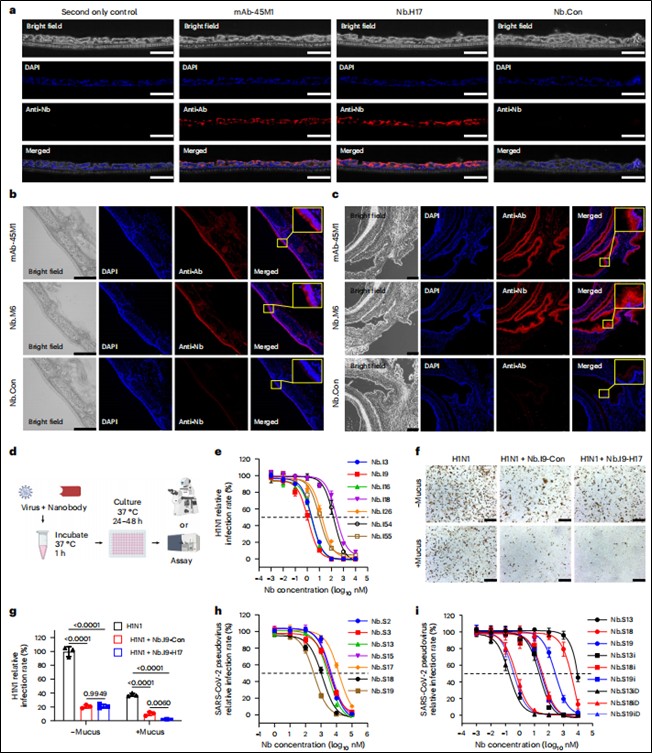
纳米抗体结合与中和验证:通过免疫荧光、Western blot验证纳米抗体与靶标(粘液/病毒蛋白)的结合;通过活病毒中和实验(H1N1/MDCK细胞)和假病毒中和实验(SARS-CoV-2/hACE2-293T细胞)评估纳米抗体的中和能力。(见图2 d、e、h、i)
图2. 黏液锚定与病毒中和功能的开发与验证
体内动物模型实验:
药代动力学研究:将荧光标记的纳米抗体经鼻给药小鼠,通过活体及离体光学成像和免疫荧光染色,比较锚定与非锚定纳米抗体在呼吸道(鼻咽、肺)的滞留时间。粘液锚定显著延长纳米抗体在呼吸道的滞留时间:体内成像显示,粘液锚定双特异性纳米抗体(Nb.I9-M6)在小鼠鼻咽和肺部的滞留时间超过72小时,显著长于非锚定版本(Nb.I9-Con)。其滞留机制是结合于粘膜表面,而非被上皮细胞摄取。(见图3)
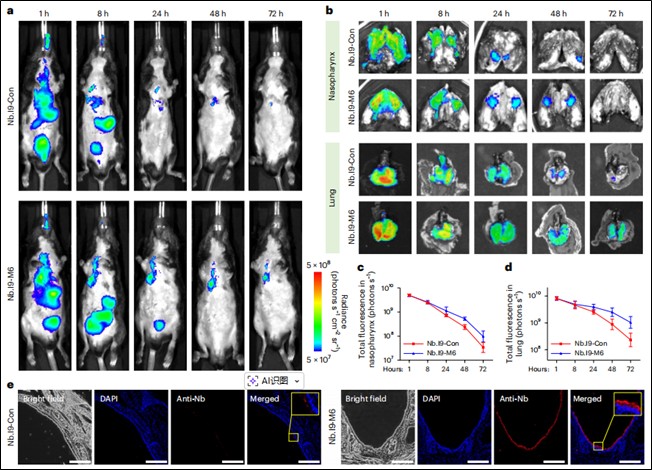
图3. 粘液锚定纳米抗体在体内的长期滞留
流感预防与治疗模型(小鼠):
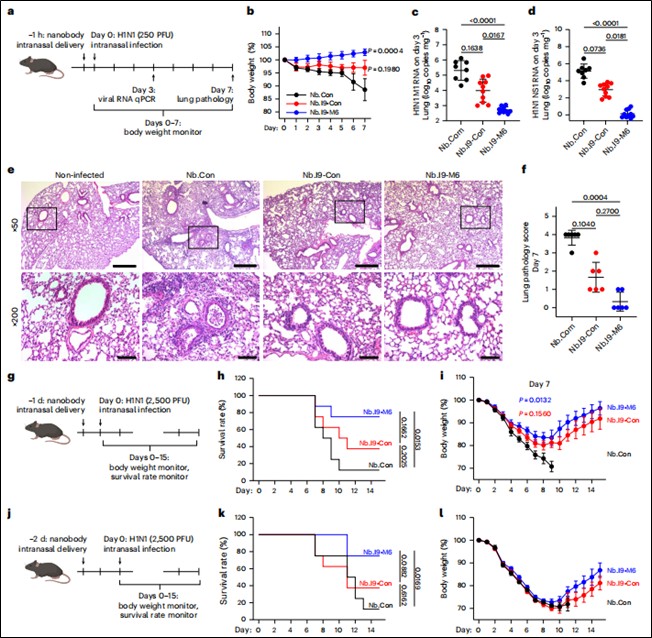
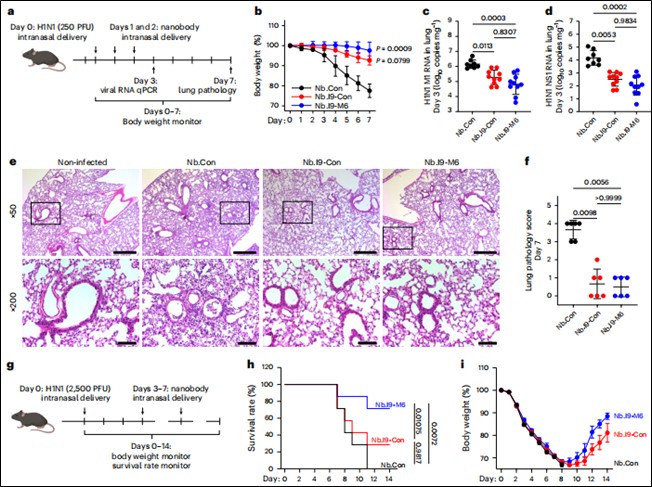
预防模型:在病毒感染前不同时间点(1小时、24小时、48小时)经鼻给予纳米抗体,使用低剂量(250 PFU)和高剂量(2500 PFU)H1N1病毒攻击,监测体重变化、生存率、肺组织病毒载量(qPCR检测M1/NS1基因)和病理损伤。(见图4)
图4. 黏液锚定双特异性纳米抗体可预防小鼠H1N1病毒感染
治疗模型:在病毒感染后第1~2天或第3—7天开始经鼻给予纳米抗体,评估其对已感染动物的治疗效果。(见图5)
图5. 黏液锚定双特异性纳米抗体在H1N1-中的治疗效果
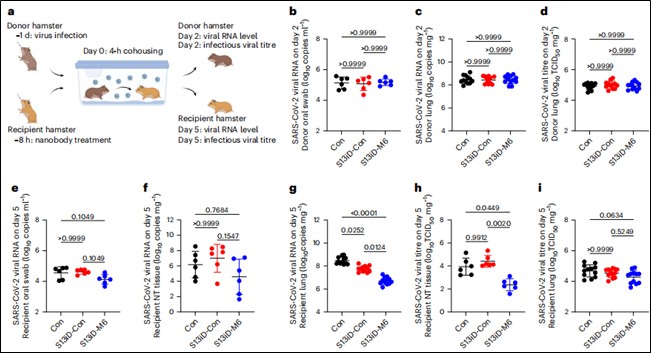
SARS-CoV-2传播模型(仓鼠):
建立共居传播模型:先感染“供体”仓鼠,再让经纳米抗体预处理的“受体”仓鼠与其共居一定时间。监测受体仓鼠的体重、上/下呼吸道(口腔拭子、鼻甲、肺)的病毒RNA载量和感染性病毒滴度,评估纳米抗体阻断病毒传播的效果(见图6)。
图6. 在8小时预处理的仓鼠共居模型中,黏液锚定双特异性纳米抗体可降低SARS-CoV-2传播
结论:本研究提出并验证了一种创新的黏膜免疫增强策略:通过工程化构建双特异性纳米抗体,使其同时靶向呼吸道病毒表面蛋白和黏膜层的黏液蛋白(MUC5AC)。这种“锚定”策略能够将病毒颗粒“拴”在黏液层中,物理性阻止其接触并感染下层上皮细胞;显著延长治疗分子在呼吸道感染部位的滞留时间,实现长效保护;在流感小鼠模型和SARS-CoV-2仓鼠传播模型中,均证明能有效预防感染、减轻疾病严重程度并阻断病毒传播,兼具预防和治疗潜力;该策略绕过了诱导主动免疫应答所需的漫长时间,提供了一种“即用型”的粘膜防御手段。
意义:这项研究开发了一种有前景的、即用型的生物制剂平台,通过增强病毒-粘液相互作用来“拦截”病原体,为预防和治疗呼吸道病毒感染提供了新的有力工具。推动纳米抗体在黏膜免疫中的应用,展示了纳米抗体因其小尺寸、易工程化、稳定性好等特点,在粘膜药物递送和局部免疫治疗中的独特优势。提示了未来优化方向,研究也指出,针对不同物种或个体优化粘液结合纳米抗体的亲和力,是最大化其保护效果的关键。未来可与靶向病毒保守表位的策略结合,以应对病毒变异。
纳博生命拥有NabLib®平台所具备的 pDual改进型双功能噬菌体展示技术,能够在传统噬菌体展示的高效开发的基础上,无缝衔接哺乳动物细胞高效生产,大大提高筛除问题分子的效率;而NabLib®哺乳动物细胞展示技术,不仅可以提升筛选分子的可开发性,还可以灵活地选择抗体的筛选构型,为下游抗体分子的应用和检测提供更好的保障。