趋化因子与其受体并非以一对一的模式相互作用,它们通常能与多个对象相互结合构成复杂的网络系统,并可在多种疾病中起到重要作用。然而CXCR4与CXCL12则比较特殊,它们是一对一的受配体关系。CXCR12对淋巴细胞有强烈的趋化作用,其特异受体CXCR4是目前用于提取纯化HIV病毒的几个趋化因子受体之一,但CXCR4的作用领域远不止于此,它可参与体内多种生理机制。如:造血功能、胚胎发育、调节肿瘤细胞的迁移与增殖等[2]。
以CXCR4为靶点的肿瘤治疗研究方向已相当成熟。如针对PI-3K-AKT的研究中发现,在胃癌细胞中,由于CXCL12-CXCR4的结合激活了PI3Kγ,而后通过与其调节亚基相结合,进而激活 PI3Kγ的下游的信号分子,如核因子κB、蛋白激酶 B,细胞外调节蛋白激酶1/2和有丝分裂原激活蛋白激酶等表达 [3,4]。
而在血液肿瘤方面,早在2008年就有全球首个CXCR4拮抗剂药物(Plerixafor)在欧美获批上市,与G-CSF结合使用可用于接受自体造血干细胞移植患者,以提高动员效果。
CXCR4不仅在肿瘤疾病中发挥关键作用,还与一些免疫性疾病如系统性红斑狼疮、风湿性相关疾病以及病毒疾病HIV有密切关系。
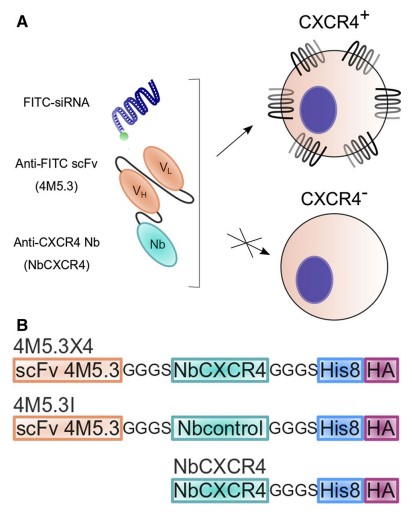
2019年,由Springer瑞士分公司收录发表的学术研究中认为针对CXCR4的靶向递送疗法对肿瘤疾病确有很好的疗效。但以细胞受配体或基于抗体的传统形式对非肿瘤疾病(如HIV病毒感染)的治疗仍存在很大的障碍。而在该研究项目中,科研人员利用靶向CXCR4的纳米抗体(NbCXCR4)与一个带有siRNA的抗荧光素(FITC)scFv片段融合而成的嵌合蛋白(4M5.3X4)。得益于纳米抗体的小分子体积与稳定性该嵌合蛋白可精准地、有选择性地将siRNA递送至CXCR4阳性细胞中,并与之结合释放。
图为靶向CXCR4+的4M5.3X4嵌合体设计[5]
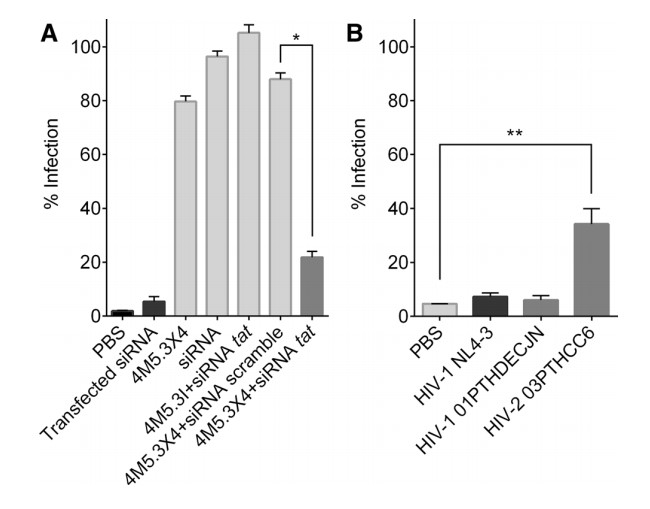
为了评估该嵌合体靶向提送siRNA的抑制作用,研究团队利用HIV-1的NL4-3毒株对人T淋巴瘤细胞SUP-T1进行感染24小时后,将4M5.3X4靶向至阳性细胞并释放siRNA。通过检测,在T淋巴细胞系中减少了约80%的HIV复制率(p≤0.05)。且研究团队发现只有4M5.3X4这一种嵌合蛋白能够抑制NL4-3的感染,而对照实验中其他的嵌合蛋白均无法起到抑制作用。更为重要的是,该嵌合体对HIV-1分离毒株01PTHDECJN的重组株CRF02_AG的抑制率达90%以上,同时对HIV-2分离毒株03PTHCC6有着约为65%的抑制率。
图为4M5.3X4嵌合体对NL4-3的抑制作用[5]
通过这些研究,我们可轻易看到CXCR4对于各类肿瘤新型治疗策略的强大潜力,同时也不难从上述研究项目中感知到CXCR4对于HIV感染的治疗策略,甚至可延伸出其他多种非肿瘤疾病的治疗策略研发,如:眼部疾病、肝脏疾病等。
纳博生命专注于纳米抗体开发、改造及应用。旨在为广大科研院所、生物制药企业提供高品质、高性价比的纳米抗体CRO服务。目前已推出的趋化因子纳米抗体有IL-2、IL-18及IL-18Binding Protein可供为广大客户直接购买。同时也可提供其他任意的纳米抗体定制服务。