中国预防医学杂志指出,我国女性的抑郁发病率远高于男性,15~19岁发病率高于其他年龄段[1]。中国精神卫生调查结果显示,我国成年人抑郁障碍的终生患病率为6.8%,其中抑郁症为3.4%,患者可能高达9500万[2]。而焦虑症通常与抑郁症伴随发病,抑郁症患者中约有六至九成伴有焦虑症,而焦虑症方面约有半数患者伴随抑郁症发作,二者共病率约为20%~80%。此二者均存在高自杀、高致残的风险,根据丽水市第二人民医院精神科的抑郁症患者收治统计中,有自杀意念的抑郁症患者占比高达54.46%[3],最终约有15%的患者死于自杀,这种结局无论对于家庭还是社会而言,都是一种沉痛的、放大化的破坏和伤害。

这些疾病在现阶段医学研究中通常认为与遗传、大脑病变、后天生活环境及其他疾病有高度的关联性,但仍尚未完全明确其具体的发病机制。抑郁症形成原因极其复杂,临床发现其发生与发展和多种因素均有关联,除去普遍认知的遗传、生活环境、心理因素影响等,其发展可能还与脂质代谢异常、睡眠障碍、认知障碍等等相互关联。神经影像学研究表明,抑郁症患者的大脑区域表现出局灶性功能和结构异常,异常脑区涉及:海马体、内侧前额叶(MPFC)、背外侧前额叶(DLPFC)、前扣带回(ACC)、后扣带回、楔前叶(PCC/PCU)、杏仁核和尾状核等[4]。研究认为海马体和前额叶是抑郁症发病的关键脑区[5],相关研究也说明由于多个大脑神经网络的连接障碍、功能紊乱或结构改变如:前扣带回-丘脑、前额叶-丘脑、前额区域之间的结构改变均表明抑郁症与大脑神经网络之间的相互关联[6]。
而目前针对抑郁症的药物类型以三/四环类抗抑郁药、选择性5-羟色胺再摄取抑制剂(SSRIs)、5-羟色胺和去甲肾上腺素再摄取抑制剂(SNRIs)、单氧化酶抑制剂(MAOIs)等等。人们熟知的可能以氟西汀、氟伏沙明、文拉法辛、马普替林、度洛西汀等。而这些药品仍远不能满足目前的临床需求,且无一例外的在神经、消化及心血管、内分泌系统方面均有程度不一的不良反应,如头疼头晕、恶心、口干、心动过速或直立性低血压、疲乏、厌食、入睡困难等,甚至部分药品还会加重焦虑、导致免疫失调等情况发生。
因此,应对抑郁症及其共发疾病的低副作用、高安全性的新型治疗药物研发需求可能更为迫切。
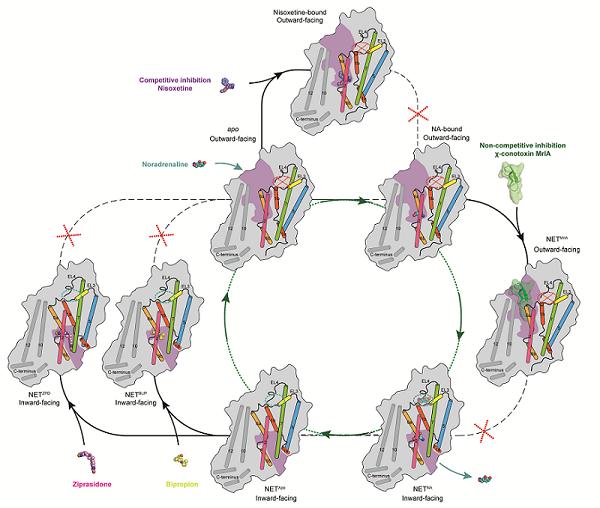
NET的转运循环及多种抑制模式-图源中科院
去甲肾上腺素(NA)主要由交感节后神经元和脑内去甲肾上腺素能神经元合成和分泌,是一种重要的神经递质,对于调节大脑和身体的活跃状态有重大作用。当神经冲动传递到神经末梢时,去甲肾上腺素被释放到突触间隙,与突触后膜上的受体结合,发挥其生理作用。而去甲肾上腺素转运体(NET)则通过主动转运将未结合的NA重新摄取回神经细胞内,使其重新储存或被代谢。当其系统功能障碍时可导致注意力缺陷多动障碍(ADHD)、自主神经功能衰竭、抑郁症等疾病的发生。对于抑郁症而言,通过抑制NET重新摄取NA可相对有效的达到治疗效果,如安非他酮以及齐拉西酮,但此类药物常常导致如恶心、头痛、失眠和口干等副作用。

7月31日,由中科院生物物理研究所赵岩团队与丹麦哥本哈根大学Claus Loland团队合作的研究中,通过单颗粒冷冻电镜技术解析了人源去甲肾上腺素转运体(NET)在不同状态下的高分辨率结构,揭示了 NET 的转运机制以及与不同药物分子的结合模式[7]。
而观察近期除上述研究以外,早至5月15日,由中科院上海药研所徐华强课题组、杨德华课题组和临港实验室蒋轶课题组合作完成破解NET同源二聚化及转运调控机制。8月14日,中国医学科学院药物研究所吴惊香团队解析人源去甲肾上腺素转运体(hNET)进一步地揭示了以hNET为靶点的药物设计策略[8]。
这些研究各有所长,为新型药物的开发提供了结构基础,有助于开发更有效、副作用更低的抑郁症、注意力缺陷多动障碍等疾病以及疼痛缓解的治疗药物。


在另一方面,早有研究证明压力会导致脑神经系统功能障碍并逐步产生慢性轻度的炎症反应,因而导致抑郁症的产生。早些时候,由日本国家神经科学研究所科研团队认为慢性压力会导致血液中血管内皮生长因子(VEGF)的表达量增加从而引起血脑屏障功能障碍[9]。而近期,西奈山伊坎医学院研究团队的研究中所揭示的抑郁症产生原因是由于骨髓释放到血液中的单核细胞进入大脑伏隔核等区域后,所释放的蛋白酶改变了神经元功能,最终导致“奖赏系统”功能障碍而引起抑郁症的发生[10]。
因此可进行推测是由于血脑屏障通透性的异常增加从而导致原本无法穿过血脑屏障的细胞等物质可轻松地进入大脑并可改变神经元结构和功能,最终致使抑郁症和其相关疾病的产生,而血脑屏障功能障碍的主要原因则与VEGF密切相关。
VEGF是一种高度特异性的促血管内皮细胞生长因子,它具有增加血管通透性、促进血管内皮细胞迁移等作用,又可称为血管通透因子(VPF)并参与了多种血管生成依赖性疾病的发展过程,如癌症、糖尿病视网膜病变等。VEGF具有多种亚型和多种受体,其中VEGF-R2是生理作用最强的受体,几乎可介导VEGF所有的生理功能。VEGF本身具有诱导海马体神经元增殖、促进轴突生长增加树突棘密度的作用,并可在VEGF-R2的介导下主要通过PI3K/Akt、MAPK/ERK等信号通路完成这些工作。
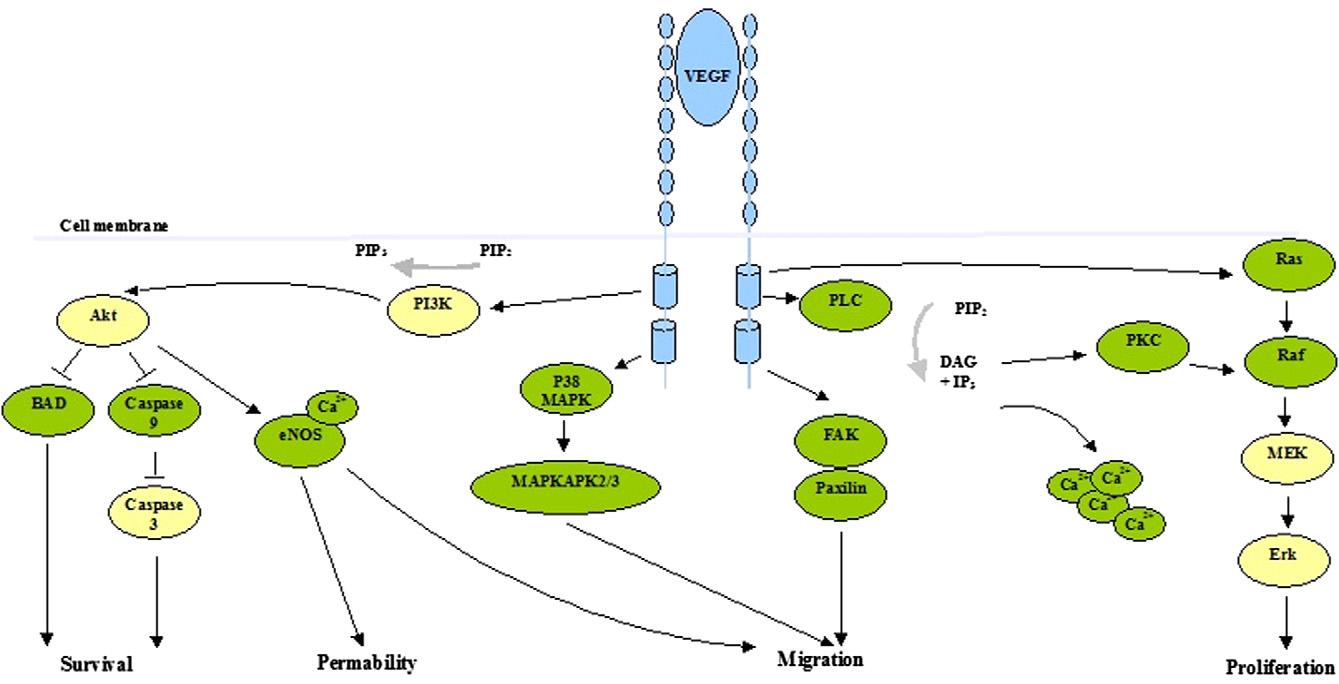
VEGFR2介导的信号转导[12]
学者通过对慢性压力模型小鼠的研究发现,小鼠血清及海马体中的VEGF表达量较于对照组明显增加,同时VEGF与VEGF-R2的异常结合而错误的导致血脑屏障通透性增加最终引起一系列的抑郁症发展过程中起关键作用,因此VEGF/VEGF-R2可能是治疗因血脑屏障功能障碍型抑郁症的潜在靶点和检测标志物[9]。
但其他的研究表明抑郁症患者在接受抗抑郁治疗后,其血清中的VEGF表达量低于健康人,且表达量与病情严重程度及年龄大小成正比[11]。由波兰西里西亚医科大学药理学院研究人员在实验过程中发现,VEGF-R2拮抗剂的使用可完全或显著地阻断电休克诱导的断海马齿状回颗粒下层(SGZ)细胞增殖,并完全阻断了氟西汀和地西帕明的抗抑郁药物疗效[12]。此项研究虽仍然证明了VEGF-R2的潜在靶点研究价值,但同时也与上述研究结果具有明显差异性。
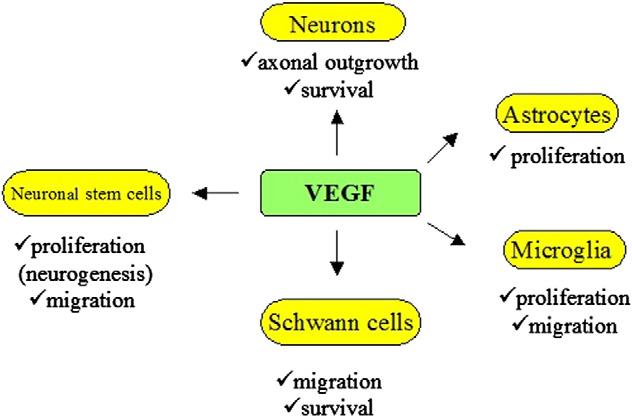
VEGF对中枢神经和外周神经细胞的多效性影响[12]
当前,抗抑郁的研究方向众多。其中,各个针对VEGF/VEGF-R2与抑郁障碍的靶向研究的过程和其结果差异化过大,因而无法完全确认二者之前的根本关系,但将VEGF作为检测抑郁或抑郁治疗效果的标志检测物,以及针对因血脑屏障通透性增加导致的抑郁症研究中通过抑制VEGF-R2能否作为抗抑郁联合疗法,还有在抑制血脑屏障通透性后,利用纳米抗体作为药物载体或药物本身对海马体或伏隔核等区域进行修复性治疗的研究,这些均是未来的可行性研究通路。纳米抗体具有体积小、特异性强等优势,在穿越血脑屏障方面展现出巨大潜力,为抑郁症的治疗提供了新的思路和方法。
此外,还有对前额叶皮层 GABA 能神经元功能失调机制的研究,以及通过肠道菌群、星状胶质细胞等方面进行抗抑郁或共发病的研究。每一种研究都为抗抑郁做出了重大贡献。
与此同时,我们也应重点关注抑郁症高发人群,做好抑郁症及共发病的预防工作,帮助抑郁人群摆脱困境,回归家庭和社会。

纳博生命专注于纳米抗体的开发、改造与应用,拥有符合实验动物标准的羊驼繁育基地与独立实验基地。致力于构建产、学、研一体化的实验公共服务平台。希望能为广大生物科研机构、医药研发企业和创新团队提供更专业、性价比更高的实验服务。欢迎各方研发人员与我们交流联系。
参考文献:
[1]江笑寒,曾智.中国儿童青少年抑郁症疾病负担变化趋势分析[J].中国预防医学杂志,2024,25(03):379-384.DOI:10.16506/j.1009-6639.2024.03.021.
[2] Huang Y, Wang Y, Wang H, et al. Prevalence of mental disorders in China:a cross-sectional epidemiological study [J]. Lancet Psychiatry,2019,6 (3):211-224.
[3]陈静 & 施旭爱.抑郁症患者自杀意念调查及其与家庭功能的关系:情绪调节自我效能感的中介作用.中国健康心理学杂志1-12.
[4] ROLLS E T.Attractor cortical neurodynamics, schizophrenia, and depression[J].Transl Psychiatry,2021,11(1):215.
[5]牟静平,成财,梅兰,等 . 抑郁症灰白质表面积性别差异研 究 [J]. 磁共振成像,2021,12(1):21-26,37.
[6]李芃菲, et al."抑郁症发病的脑功能机制研究进展."中国医学创新 21.05(2024):165-169.
[7]Hu T, Yu Z, Zhao J, Meng Y, Salomon K, Bai Q, Wei Y, Zhang J, Xu S, Dai Q, Yu R, Yang B, Loland CJ, Zhao Y. Transport and inhibition mechanisms of the human noradrenaline transporter. Nature. 2024 Aug;632(8026):930-937. doi: 10.1038/s41586-024-07638-z. Epub 2024 Jul 31. PMID: 39085602.
[8]Ji W, Miao A, Liang K, Liu J, Qi Y, Zhou Y, Duan X, Sun J, Lai L, Wu JX. Substrate binding and inhibition mechanism of norepinephrine transporter. Nature. 2024 Aug 14. doi: 10.1038/s41586-024-07810-5. Epub ahead of print. PMID: 39143211.
[9]Matsuno H, Tsuchimine S, O'Hashi K, Sakai K, Hattori K, Hidese S, Nakajima S, Chiba S, Yoshimura A, Fukuzato N, Kando M, Tatsumi M, Ogawa S, Ichinohe N, Kunugi H, Sohya K. Association between vascular endothelial growth factor-mediated blood-brain barrier dysfunction and stress-induced depression. Mol Psychiatry. 2022 Sep;27(9):3822-3832. doi: 10.1038/s41380-022-01618-3. Epub 2022 May 26. PMID: 35618888.
[10]Cathomas F, Lin HY, Chan KL, Li L, Parise LF, Alvarez J, Durand-de Cuttoli R, Aubry AV, Muhareb S, Desland F, Shimo Y, Ramakrishnan A, Estill M, Ferrer-Pérez C, Parise EM, Wilk CM, Kaster MP, Wang J, Sowa A, Janssen WG, Costi S, Rahman A, Fernandez N, Campbell M, Swirski FK, Nestler EJ, Shen L, Merad M, Murrough JW, Russo SJ. Circulating myeloid-derived MMP8 in stress susceptibility and depression. Nature. 2024 Feb;626(8001):1108-1115. doi: 10.1038/s41586-023-07015-2. Epub 2024 Feb 7. PMID: 38326622; PMCID: PMC10901735.
[11] Rigal, A., Colle, R., Asmar, K.E., et al. (2020) Lower Plasma Vascular Endothelial Growth Factor A in Major Depres- 吉荣图,郑兰兵DOI: 10.12677/acm.2024.1441347 2699 临床医学进展 sive Disorder Not Normalized after Antidepressant Treatment: A Case Control Study. The Australian and New Zealand Journal of Psychiatry, 54, 402-408. https://doi.org/10.1177/0004867419893433
[12]Nowacka MM, Obuchowicz E. Vascular endothelial growth factor (VEGF) and its role in the central nervous system: a new element in the neurotrophic hypothesis of antidepressant drug action. Neuropeptides. 2012 Feb;46(1):1-10. doi: 10.1016/j.npep.2011.05.005. Epub 2011 Jun 29. PMID: 21719103.







