由于艾滋病高传染率和高危险性,且无法彻底治愈的特性使得人们产生高度恐慌的“恐艾”心理。自1981年首次报告艾滋病以来,从抗逆转录病毒药物齐多夫定(AZT)的问世,发展到后期的双药联合疗法对于该疾病的疗效均不尽人意,再至高效抗逆转录病毒疗法(ART、三药联合疗法/鸡尾酒疗法)的出现才让治疗效果取得了相对巨大的提升,在降低病毒耐药性的同时也显著延长了患者的生存率。有研究指出70%患者经过“鸡尾酒疗法”治疗三至六月后,在其外周血中几乎无法检测到HIV病毒。该疗法通常使用三种以上的药物进行组合治疗,一般采用两种核苷类反转录酶抑制剂和一种蛋白酶抑制剂,或两种核苷类反转录酶抑制剂和一种非核苷类反转录酶抑制剂进行治疗,然而该疗法的高依从性需求对于大部分患者而言相当困难,一旦停药病毒载量就会回弹[1],由于不遵循或不完全遵循医嘱而导致耐药风险的增加和治疗效果的大幅降低。
不可否认,高效抗逆转录病毒疗法(ART)的出现在抑制 HIV 复制方面取得了一定进展,将艾滋病从临床绝症改变为一种可控疾病,为防治艾滋作出了巨大的贡献。然而近年越来越多的研究证据表明该疗法可明显增加患者心血管疾病、高乳酸血症、胰岛素抵抗等疾病发作的可能性[2],目前认为ART药物通过改变脂质代谢而造成代谢障碍,以及对组织直接伤害两种机制引发患者心血管疾病的发生。有报告表明患者在服用3个月的药物后,血浆中胆固醇、甘油三酯及低密度脂蛋白胆固醇含量明显上升,而高密度脂蛋白胆固醇明显下降[3];接受ART药物治疗的患者比其他患者的高血压发病率提升一倍[4];而齐多夫定及印地那韦药物则会损伤血管内皮细胞,进而刺激其分泌内皮素-1(endothelin-1, ET-1)并反向刺激了血管平滑肌细胞的增殖能力等 一系列的反应,最终导致动脉硬化[5]等等。
(正在复制的HIV病毒)
在非药物治疗方面:今年7月举行的世界艾滋病大会上,由德国沙里泰大学医院研究人员报告称一名患者在接受干细胞移植后成为未接受ART治疗的第7位被治愈患者。然而干细胞移植手术费用高昂且成功率低下,加之术后的排异反应作为患者痊愈的第二道考验使得该方法并未获得广泛推广。尽管在科学家们经过多年的药物和治疗策略研究下已可以让患者回归社会,但无法彻底治愈这一根本仍让患者饱受社会的排斥和歧视,且目前主流疗法仍存在副作用和耐药性等问题。因此,寻找更有效、更低耐药性、更广谱的治疗方法至关重要。
由于HIV病毒具有高度变异性,对其治疗或免疫的研究无法单纯地从一种病毒的角度出发。HIV病毒在感染人体后会在宿主体内大量复制并产生大量变异,且在逃逸免疫系统的攻击时会不断改变其表面抗原结构,这种免疫压力进一步促使病毒变异最终导致病毒复制与变异的速度远超过免疫速度。同时,逆转录酶将病毒单链RNA逆转录成双链DNA而后整合到人体细胞基因组中使得免疫系统无法识别病毒亦无法进行免疫应答。因此,无数科学家均在此碰壁折腰,屡战屡败。
(表面带有HIV病毒簇的淋巴细胞)
早些时候,科学家们在不分裂细胞的细胞核中发现了完整的HIV衣壳,并发现HIV衣壳模仿了核转运蛋白的功能和进入细胞核的机制和抗病毒作用机制的可能。近期,吉利德科学公司公布的来那帕韦(HIV-1衣壳抑制剂)的相关研究也取得了进展。来那帕韦作为一种长效HIV衣壳抑制剂,能阻止HIV病毒进入人体细胞或抑制病毒生命周期的其他关键环节,与其他现有药物不存在交叉耐药性。其临床试验结果显示,在HIV预防方面具有显著效果,且优于每日服用的其他药物。
而在疫苗方面,由于HIV的复杂性注定了单一疫苗难以达到理想效果。因此科学家们采用DNA疫苗+重组蛋白疫苗和PreEP的联合应用诱导DNA中的病毒激活并使机体产生免疫应答[6],美国莫德纳医药公司在基于mRNA的HIV疫苗研究中已取得临床I期的良好表现。2024年9月,麻省理工学院研究团队在《Since Immunology》上发表研究论文,文中提及一种新的接种方案可减少疫苗接种次数并可增强接种效果。这种方案采用第一针接种20%的疫苗并在七天后注射80%的疫苗量,所产生的反应与单剂疫苗相比可使T细胞反应提升5倍,抗体反应提升60倍[7]。
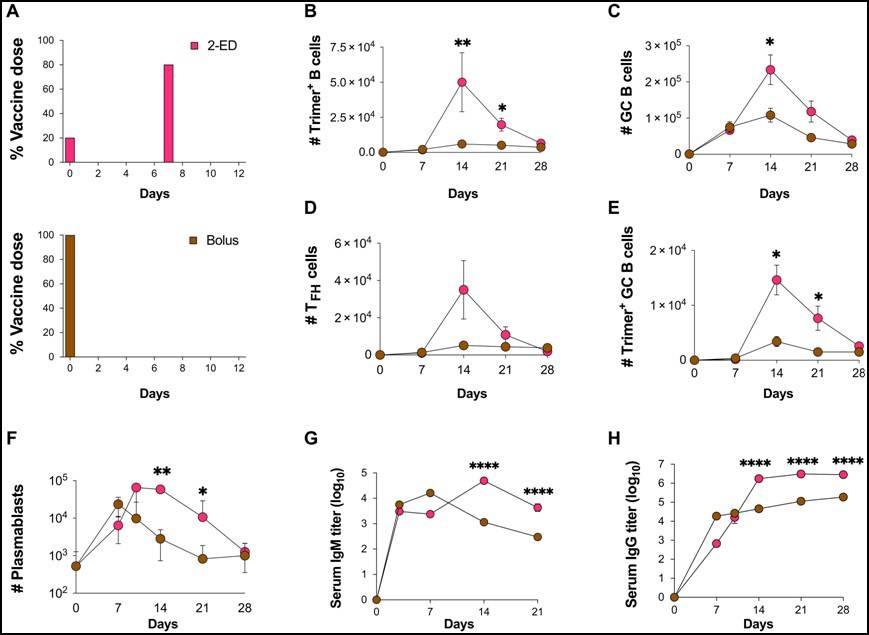
(两针疫苗注射法效价图[7])
近年来,纳米抗体(Nanobody,Nb)以自身独特的优势频繁出入科学家的眼中。由于纳米抗体自身分子量仅为14kDa且具有精准识别结合能力,可轻易到达细胞深处。这些优势使得纳米抗体同样在HIV治疗领域中同样可展现出巨大的潜力。近日,南京大学医学院吴稚伟、吴喜林的课题组通过羊驼免疫和高通量噬菌体展示技术,成功分离出一系列CD4纳米抗体。其中,一种被命名为Nb457的纳米抗体表现出了优异的性能。
在对代表全球117株HIV假病毒的检测中,Nb457纳米抗体的广谱性为99.1%,抗病毒活性为pM级,其广谱性和抗病毒活性明显优于现有的HIV中和抗体。此外,工程化改造的“乌纱帽”型三聚体纳米抗体Nb457-NbHSA-Nb457在HIV-1活病毒测试中实现了病毒的100%完全抑制,这一发现提示新型工程改造后的纳米抗体可以更好地抑制病毒感染,同时不易引发HIV的病毒耐药逃逸。基于前期构建的HIV感染的免疫系统人源化小鼠实验,该三聚体纳米抗体的治疗效果显著,在一些小鼠体中几乎检测不到HIV病毒,且未观察到耐药突变。这两项证据均可表明Nb457纳米抗体具有明显降低病毒逃逸可能性的作用,可极大地避免了耐药性产生。
为了深入解析纳米抗体的作用机制,研究团队进行了晶体结构解析。他们发现Nb457通过与CD4结合,诱导了CD4的D1结构域构象改变,从而有效地阻碍了HIV-1的gp120与CD4细胞的结合。同时,Nb457的表位位于MHC-II结合位点的另一侧,避免了对MHC-II结合的干扰,进一步验证了其良好的安全性[8]。
尽管目前针对HIV病毒的预防和治疗领域取得了一些较为有效的研究进展,但艾滋病仍无法治愈。推广预防措施、控制艾滋病扩散、消除社会歧视等措施是当下最为紧要的工作,同样,我们更期待看到更多创新药物的出现而终结HIV的流行。

纳博生命专注于纳米抗体的开发、改造与应用,拥有符合实验动物标准的羊驼繁育基地与独立实验基地。致力于构建产、学、研一体化的实验公共服务平台。希望能为广大生物科研机构、医药研发企业和创新团队提供更专业、性价比更高的实验服务。欢迎各方研发人员与我们交流联系。