随着病情的进展,患者逐渐失去独立生活的能力,需要长期精细的护理和照顾。目前,尽管有一些药物可以缓解症状,但仍缺乏有效的治疗方法。如多奈哌齐、卡巴拉汀此类胆碱酯酶抑制剂会导致恶心、呕吐、失眠、头晕等不良症状,且随着病情发展会逐渐失效;NMDA受体拮抗剂药物在服用后主要引发神经系统不良反应,除头痛、嗜睡以外,甚至可能引起幻觉和意识紊乱等症状。
今年9月24日,礼来宣布由其研发治疗阿尔茨海默病的药物多奈单抗(Donanemab)已获得美国FDA和日本厚生省的批准,为患者提供了继仑卡奈单抗(Lecanemab)和阿杜那单抗(Aducanumab)之后的新治疗选择,该药物可延缓AD的病情发展。然而目前这些药物在副作用及疗效仍存在一定争议[1]。Aducanumab在2021年获FDA批准上市之后因疗效和安全性问题在今年1月31日宣布退市,另一项由罗氏研发的甘特单抗(Gantenerumab)也于2022年末因疗效问题宣布临床III期实验失败。因此,具有高疗效、低副作用的新型药物研发仍是关键。
我国是世界上老龄人口最多、增长最快的国家之一。在此环境之下,AD在我国已成为多发病和常见病,是我国居民死亡的第五大原因,根据整体患病率和死亡率数据来看,女性高于男性,我国高于全球平均水平。目前我国已有AD患者近千万计,并已成为治疗费用最高昂、家庭负担最重的疾病之一[2]。
该病近年来已逐渐趋向年轻化,北京宣武医院贾建平团队在《AD杂志》上报道了一例极为罕见的病例,该病例患者仅有19岁,患者在就诊两年前就已经出现明显的短期记忆缺失等症状,医院对患者采取了多种检测方式,包括脑脊液指标检查以及PET扫描,最终对其临床诊断为AD。而此前最年轻的患者虽仅有21岁,但其携带有一种基因突变,而宣武医院接诊的该病例并未发现有携带已知的相关基因突变[3]。
我国居民对AD普遍存在认知程度低、就诊率低、接受治疗比例低的现状,且同时存在对患者有照顾能力不足、治疗资源匮乏、模式单一等问题,每年因发病而走失的患者老人不计其数,日常的治疗与护理对于患者本身与患者家庭而言都是精神和经济的双重负担。

由于AD的病理机制尚未完全明确,但目前认为与多种因素有关,包括遗传因素、环境因素、神经递质失衡、氧化应激和炎症反应等。病理机制也有众多假说,如线粒体级联假说、炎症假说、神经血管假说等。其中,胆碱假说、β-淀粉样蛋白(amyloid-β,Aβ)假说和tau蛋白假说目前被学术界认为是主流观点。
研究认为β-淀粉样蛋白(amyloid-β,Aβ)在被分割出来以后有众多Aβ亚型,其中Aβ42具有高神经毒性,在大量沉积后会造成神经突触损伤、神经元死亡、诱发免疫炎症反应和氧化应激[4-7]。
而tau蛋白过度磷酸化后会改变其本来结构,聚集成为神经元纤维缠结导致突触丧失,影响了神经元之间正常的信号传递。同时,胆碱能神经元的研究认为由于Aβ病理性趁机破坏了由胆碱能神经元分泌的神经生长因子(NGF)的代谢通路,最终使基底前脑神经元突触萎缩、胆碱能系统功能丧失,从而加剧Aβ蛋白沉积和异常tau蛋白聚集的病理表现[8]。
Aβ蛋白聚集体主要在神经元之间形成,而异常tau蛋白聚集体主要集中在神经细胞内部。以往大多数治疗手段无法有效穿透血脑屏障清除Aβ蛋白沉积,更妄论可到达细胞内部针对tau蛋白进行清除工作。研究人员利用纳米抗体开发了一种多价纳米抗体偶联物,以实现同时抑制Aβ生成、消除活性氧(ROS)支架并清除Aβ斑块。针对另一个方向:异常tau蛋白缠结的研究中,研究人员设计出一种双特异性纳米抗体可以有效穿过血脑屏障并参与tau蛋白缠结的降解工作,同时也能有效地抑制异常tau蛋白的重新聚集[9,10]。
近期,剑桥大学的研究团队分别在Cell和Science上发表了两项研究,研究均利用了TRIM21精准靶向并清除异常tau蛋白的两种新方法。TRIM21即三重基序蛋白(Tripartite motif protein,TRIM)家族成员之一,其具有E3泛素连接酶活性功能,能够靶向目标蛋白进行降解,包括病毒、Aβ蛋白和tau蛋白,而这两种方法均利用了纳米抗体作为其嵌合体针对tau蛋白进行降解。
RING-Bait诱饵策略
发表于Cell的研究由剑桥大学Leo C. James团队设计出一种命名为RING-Bait的融合蛋白策略。在将该策略应用于tau蛋白研究时,研究团队将TRIM21的RING结构域与tau蛋白C末端相融合后得到tau-RING融合蛋白。
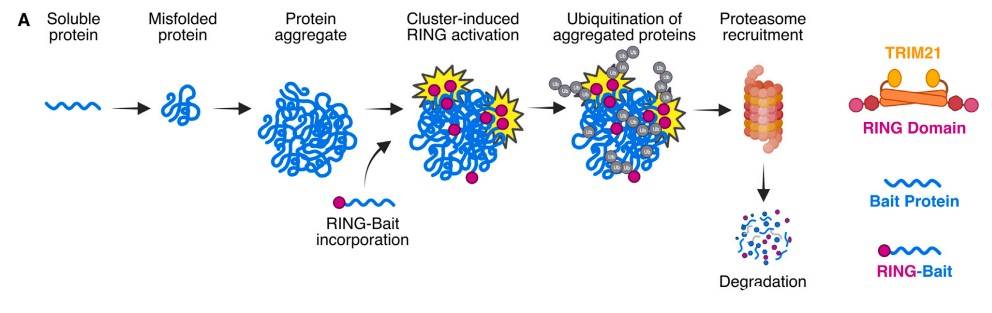
RING-Bati技术示意图[11]
tau-RING在可以被招募到神经元细胞内tau聚集体中,一旦结合成功则会被激活其E3功能,进而启动对tau聚集体进行降解,逆转tau缠结状态。为了验证该融合蛋白与tau聚集体的特异性作用,研究团队使用了纳米抗体构建体作为对照,发现nanobody-RING不能显著的作为诱饵产生特异性作用。这表明了tau-RING可以特异性降解tau蛋白,并与RING-Bait技术旨在降解聚集体的目标是一致的,且该技术的出现也为未来同类型的聚集体降解机制提供了全新的研究思路。
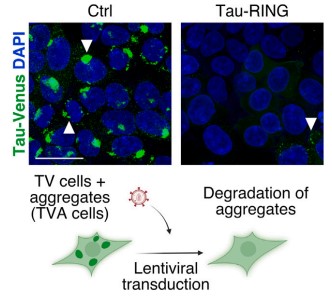
当tau-RING与tau聚集体结合72小时后的变化[11]
纳米抗体聚合体策略
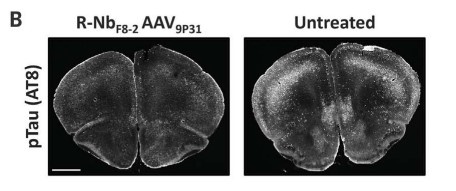
另一项研究是由剑桥大学William A. McEwan团队完成,该团队将TRIM21的RING结构域与一种靶向特异性纳米抗体结合,形成能够在核质中表达的RING-纳米抗体(R-Nb)结合体,并选择针对tau蛋白C末端的纳米抗体F8-2的变体作为靶向结构域形成融合蛋白R-NbF8-2。
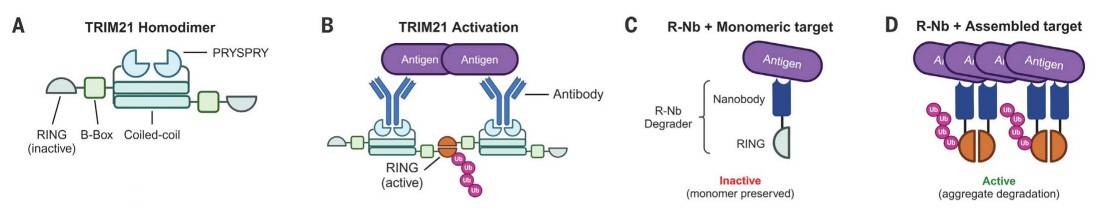
RING-nanobody降解剂结构示意图[12]
实验结果表明R-NbF8-2能够有效降解神经元细胞内的tau蛋白聚集体,并抑制新的异常tau蛋白形成和聚集,同时该方法还规避了对正常tau蛋白的清除。为了验证该融合蛋白是否能够快速降解tau蛋白聚集,研究团队分别设计以10天和30天的实验对照发现该融合蛋白仅在注射后的10天就已经完成了降解工作,与30天实验相比没有差异。
对模型小鼠使用R-NbF8-2融合蛋白10天后的差异[12]
相关研究拓展
在更早些的时候,由密歇根大学、约翰霍普金斯大学及清华大学研究团队针对α-突触核蛋白(α-syn)进行了一项研究,α-syn是一种类似朊病毒蛋白,为路易体痴呆(LBD)和帕金森病(PD)的主要发病机制,该研究利用纳米抗体(nanobody,Nb)设计了一种可精准靶向致病性α-突触核蛋白(α-syn)的纳米抗体PFFNB2。这种纳米抗体可以特异性识别α-syn的聚集体,并起到显著的分解作用,同时还可以有效抑制新的聚集体生成[13,14]。
同时,近日一项发表于《AD与失智症》杂志上的研究指出AD患者的脑神经病变尽管有病理机制上的重叠,但最终患病的机制并非统一的形式,而是根据不同个体之间的脑神经病变而产生差异化,脑神经或其他结构出现更多异变的人更容易患上AD[15]。这项发现很有可能开发出更多个性化或更广谱的治疗药物。
结合上述研究发现,在不远的未来针对轻重程度或致病因素均不相同的AD或其他痴呆症的治疗性研究,甚至行之有效可获批临床的方案都会出现在我们的视线当中。患者与家人的痛苦,那份揪心与悲伤也许可以不再重来。
反观Gantenerumab等单抗采用噬菌体展示平台进行,该技术在展示过程中存在的理化性质不佳、构型受限等问题或许是此类单抗药物失败的原因之一。
哺乳动物细胞展示平台具有不受限制的筛选构型、更优秀的理化性质、更接近人类的PTM和更好的可成药性等特色。纳博生命采用该技术针对anti-amyloid-β和anti-tau的纳米抗体研究已在火热进行中。

纳博生命专注于纳米抗体的开发、改造与应用,拥有符合实验动物标准的羊驼繁育基地与独立实验基地。致力于构建产、学、研一体化的实验公共服务平台。希望能为广大生物科研机构、医药研发企业和创新团队提供更专业、性价比更高的实验服务。同时,纳博生命也正针对文中纳米抗体进行开发,欢迎各方研发人员与我们交流联系。