研究发现,在RA发病过程中CD4+ T细胞扮演了关键角色。CD4+ T细胞可分化为不同的亚型,在RA患者的关节滑膜组织中,Th1和Th17亚型细胞异常活化,并大量增殖。Th1细胞分泌的干扰素-γ(IFN-γ)等细胞因子可激活巨噬细胞,增强其吞噬和抗原呈递能力,促进炎症反应。Th17细胞分泌IL-17等细胞因子能刺激滑膜细胞分泌多种炎症介质,如前列腺素E₂(PGE₂)、基质金属蛋白酶(MMPs)等,从而导致滑膜炎症和关节破坏[5,6]。CD4+ T细胞还通过细胞间的相互作用,与其他免疫细胞协同参与 RA的发病过程。如促进B细胞异常活化、增殖并分化为浆细胞,并产生如类风湿因子(RF)和抗环瓜氨酸肽(CCP)抗体等自身抗体。这些自身抗体与自身抗原结合形成免疫复合物,沉积在关节滑膜等部位,激活补体系统,引发炎症反应。同时B细胞还可作为抗原呈递细胞反向激活CD4+ T细胞,进一步加剧RA发病过程。
在炎症刺激下,滑膜细胞、软骨细胞和巨噬细胞可分泌如MMP-1、MMP-3、MMP-13等多种基质金属蛋白酶(MMPs)。它们可以降解关节软骨的细胞外基质成分,如胶原蛋白、蛋白聚糖等,导致关节软骨破坏。同时,MMPs还参与滑膜血管翳的侵袭过程,破坏软骨下骨组织。有研究发现,RA患者关节滑液中MMPs水平明显升高,且与关节破坏程度相关[7]。另一方面,由成骨细胞、滑膜细胞等表达的核因子κB(NF-κB)受体活化因子配体(RANKL)与破骨细胞前体细胞表面的RANK相结合时可激活破骨细胞,使其分化、成熟并增强其骨吸收活性,在关节软骨下骨表面形成吸收陷窝,导致骨质流失,引起关节畸形和功能障碍[8]。同时,TNF-α、IL-1等细胞因子也可直接或间接促进破骨细胞的活化。
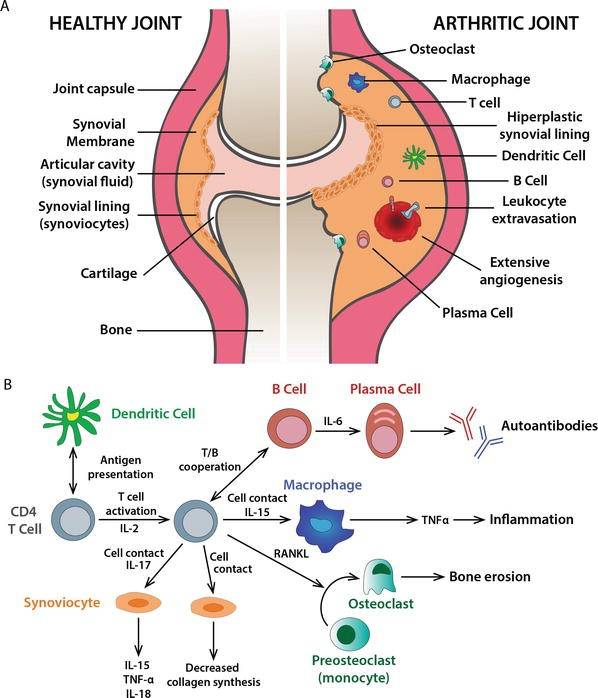
CD4+T细胞在类风湿性滑膜炎中的作用[5]
传统用于治疗类风湿药以非甾体抗炎药(NSAIDs)和改善病情抗风湿药物(DMARDs)为主。然而NSAIDs类药物,如阿司匹林、布洛芬、萘普生等,此类通过抑制环氧化酶(COX)的活性,减少前列腺素和血栓素的合成,从而发挥抗炎、镇痛和解热作用。其主要作用是缓解疼痛和减轻炎症,但此类药物并不能阻止或减缓RA的疾病进展,长期使用还可能导致胃肠道不良反应,如胃溃疡、出血、肾功能异常以及增加心血管事件的风险。DMARDs类药物种类繁多,例如甲氨蝶呤(MTX)、来氟米特、柳氮磺吡啶等。此类药物虽然可以在一定程度上改善病情,但一般需要数周甚至数月才能见效,部分患者对其治疗反应不佳,且不良反应较多并相对严重,如胃肠道反应、肝毒性、皮疹、骨髓抑制、血液系统异常等不良反应限制了其在临床中的广泛应用。
随着对RA病理机制的不断研究,生物制剂的出现为RA治疗带来了新的希望。目前生物制剂研究靶点主要以细胞因子、免疫检查点受配体以及信号通路为主要研究类型,并已有多个药物获批上市。
目前临床上常用TNF-α、ILs(白介素家族)作为药物作用的靶点。其中TNF-α抑制剂有依那西普、英夫利西单抗、阿达木单抗等。这些药物通过与TNF-α特异性结合后可阻断其生物学活性,从而减轻炎症反应,改善关节症状,延缓关节破坏。白介素家族的很多成员都被视为自体免疫疾病的靶点。例如IL-1受体拮抗剂(IL-1Ra)如阿那白滞素,可竞争性抑制IL-1与受体的结合来降低炎症指标;抗IL-17A单抗药物,如司库奇尤单抗在RA治疗的临床试验中可改善患者的关节症状和影像学进展;托珠单抗可阻断IL-6与受体的结合,抑制IL-6介导的炎症反应。此外还有FGF/FGFR家族、JAK/STAT信号通路、CD20以及CD80/86等相关的生物抑制剂的研究。
然而传统生物制剂仍然不能满足RA的药物治疗需求,且大部分存在有严重的安全隐患。例如,长期使用TNF-α抑制剂还会引起中性粒细胞减少、低丙种球蛋白血症等疾病发生;长期使用免疫检查点受配体抑制剂利,如妥昔单抗也有可能导致B细胞长期耗竭从而增加感染风险,阿巴西普除此之外还可出现输液反应;而JAK/STAT信号通路抑制剂与前者一致,同样会因长期服用导致免疫机制不活跃而引起高感染风险。

纳米抗体作为一种新型的抗体分子,以其易改造、高亲和力、免疫原性低等独特优势在生物制剂、影像学等领域成为广受好评的新型策略,在RA治疗领域展现出了巨大的潜力。
以Ozoralizumab(奥利组单抗)为例,这是由Ablynx公司以噬菌体展示技术筛选获得的一种抗TNF-α人源化纳米抗体,由两个抗人TNF-α纳米抗体和一个抗人血清白蛋白(HSA)纳米抗体组成。并在2022年在日本获批上市,成为全球首款获批上市的双特异性纳米抗体。在早期针对RA的治疗性药物研究中,研究人员发现用于治疗RA的传统型药物如阿达木单抗(Adalimumab)在长期服药过程中会导致抗药物抗体(ADAs)的形成,并随着ADAs的形成逐步丧失疗效[9],然而因Ozoralizumab在临床实验中就表现出抗人TNF-α的高亲和力优势,在长期服药治疗中并未形成明显的ADAs和严重的不良反应事件发生。同样由Ablynx公司开发的Vobarilizumab是一种靶向IL-6R的纳米抗体,由抗IL-6R纳米抗体和抗白蛋白纳米抗体两个结构域组成,后者则延长了该抗体的半衰期,可应用于RA及系统性红斑狼疮(SLE)的治疗并已进入临床II期实验当中。
随着对RA治疗药物领域不断地深入研究,赛诺菲研究人员发现靶向TNF和IL-6的治疗药物具有协同效应,继而研发可同时靶向TNF和IL-6两个靶点的治疗药物,并将科研成果发表于科学转化医学期刊[10]。该研究开发了一种双抗纳米抗体,该抗体由一个靶向TNF的VHH、两个结合IL-6的VHH以及第四个可结合人血清白蛋白以延长在体内半衰期的VHH组成,这四个VHH来自纳米抗体重链区(VHHs)的可变域,并通过甘氨酸-丝氨酸连接子连接。在ex vivo人腺样体组织模型实验中,该纳米抗体完全阻断了与RA相关的趋化因子CXCL13的诱导分泌,而在RA-FLS/T共培养实验中,该纳米抗体在抑制MMP1的分泌方面和RA-FLS/T细胞的疾病相关通路方面均比单独的TNF抗体或IL-6抗体更加有效。这个研究发现为新型RA治疗药物的未来提供了新的策略与研发方向。

纳博生命现已推出哺乳动物细胞展示技术平台。哺乳动物细胞展示平台具有不受限制的筛选构型、更优秀的理化性质、更接近人类的PTM和更好的可成药性等特色。
我们专注于纳米抗体的开发、改造与应用,拥有符合实验动物标准的羊驼繁育基地与独立实验基地。致力于构建产、学、研一体化的实验公共服务平台。希望能为广大生物科研机构、医药研发企业和创新团队提供更专业、性价比更高的实验服务。同时,纳博生命也正针对文中纳米抗体进行开发,欢迎各方研发人员与我们交流联系。







