E10 纳米抗体的发现与特性分析
与传统抗体不同,纳米抗体是一种小型单域抗体,来源于羊驼等骆驼科动物,具有许多独特优势。它们更稳定,能够穿透病毒的隐藏结构,并且更容易生产。为了找到一种能够广泛中和甲型流感病毒的纳米抗体,研究人员使用 H7N9 这一具有高度大流行潜力的流感亚型免疫羊驼,并从其外周血单核细胞(PBMCs)中分离抗体,随后构建噬菌体展示文库,筛选出可以结合流感病毒血凝素(HA)蛋白的纳米抗体。在这些候选分子中,E10 展现出了最突出的表现,不仅能够强效中和 H7N9,还能对H1N1 和 H3N2 等其他流感亚型发挥作用,这使其成为一种极具潜力的广谱抗病毒候选物。
进一步的实验表明,E10 结合于 血凝素(hemagglutinin,HA) 头部的保守区域,特别是 HA 的侧斑(lateral patch)区域,这是病毒附着宿主细胞并启动感染过程的关键位点。这一发现尤为重要,因为大多数针对 HA 头部的抗体都具有高度的株特异性,而 E10 结合的这一位点在多个流感亚型中都保持稳定。研究人员证明,E10 通过阻断 HA 与宿主受体的相互作用来抑制病毒感染。与以往关注 HA 茎部的广谱抗体不同,E10 在 HA 头部仍能实现广谱中和,这是一个极为罕见且有价值的特性。
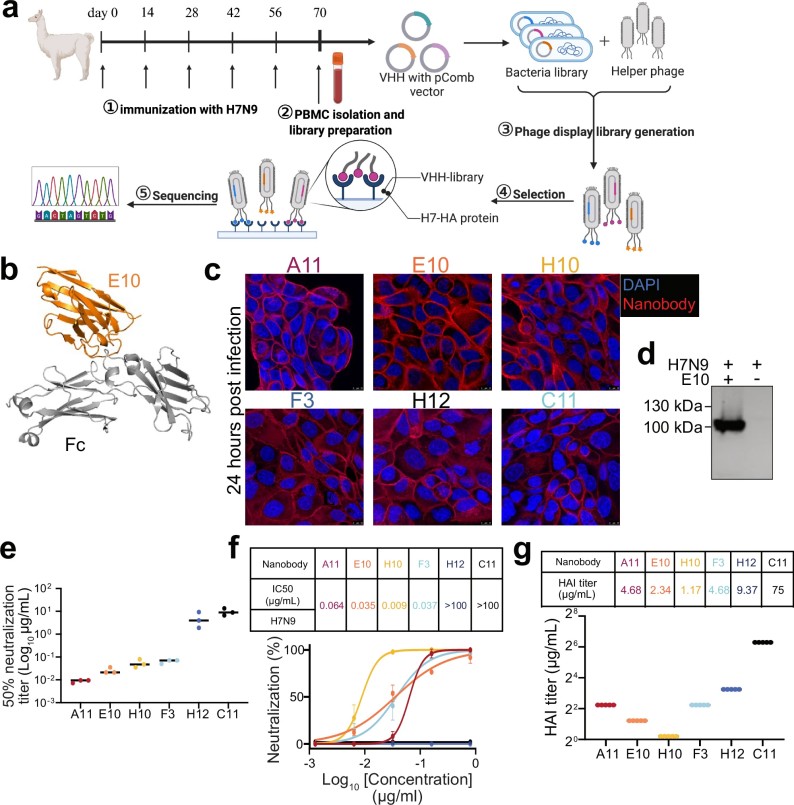
图1. H7 特异性纳米抗体的制备与特性分析。
a. 免疫化和纳米抗体选择:对羊驼使用H7N9病毒进行免疫,并进行四次加强免疫,随后收集外周血单核细胞(PBMCs),用于构建噬菌体展示文库。
b. 纳米抗体-Fc结构模型:使用ImmuneBuilder和AlphaFold 2构建纳米抗体-Fc融合蛋白的结构模型,纳米抗体以橙色表示,Fc标签为灰色。
c. 免疫荧光实验(IFA):A549细胞感染SZ19 H7N9病毒后,使用不同的纳米抗体(A11、E10、H10、F3、H12、C11)进行染色,再加用二抗(羊抗人IgG Fc Alexa Fluor™ 488)。
d. Western Blot(WB)分析:通过Western Blot分析SZ19 H7N9病毒感染的A549细胞,使用羊抗人IgG-Fc HRP标记。
e. 中和终点(NC50)实验:将纳米抗体与H7N9病毒孵育,并与细胞共培养,72小时后通过血凝试验测量病毒复制。
f. 基于ELISA的中和实验:通过细胞ELISA测定不同纳米抗体对SZ19 H7N9病毒的半最大抑制浓度(IC50)。
g. 血凝抑制(HAI)实验:进行HAI实验,评估不同纳米抗体对SZ19 H7N9病毒的抑制效果,显示抑制的滴度(单位:μg/mL)。
广谱中和与对多种流感毒株的交叉保护
为了测试 E10 的实际疗效,研究人员在小鼠体内进行了实验。结果发现,在感染 H7N9 前或感染后不久给予 E10 处理的小鼠展现出了极强的保护力,它们体重保持稳定,肺部及其他器官的病毒载量明显降低,并最终成功存活。更令人惊喜的是,E10 也能有效保护小鼠免受 H1N1 和 H3N2 的感染,这表明 E10 能够跨越流感病毒的主要进化分支(group 1 和 group 2)进行防护,具备成为通用流感疗法的潜力。
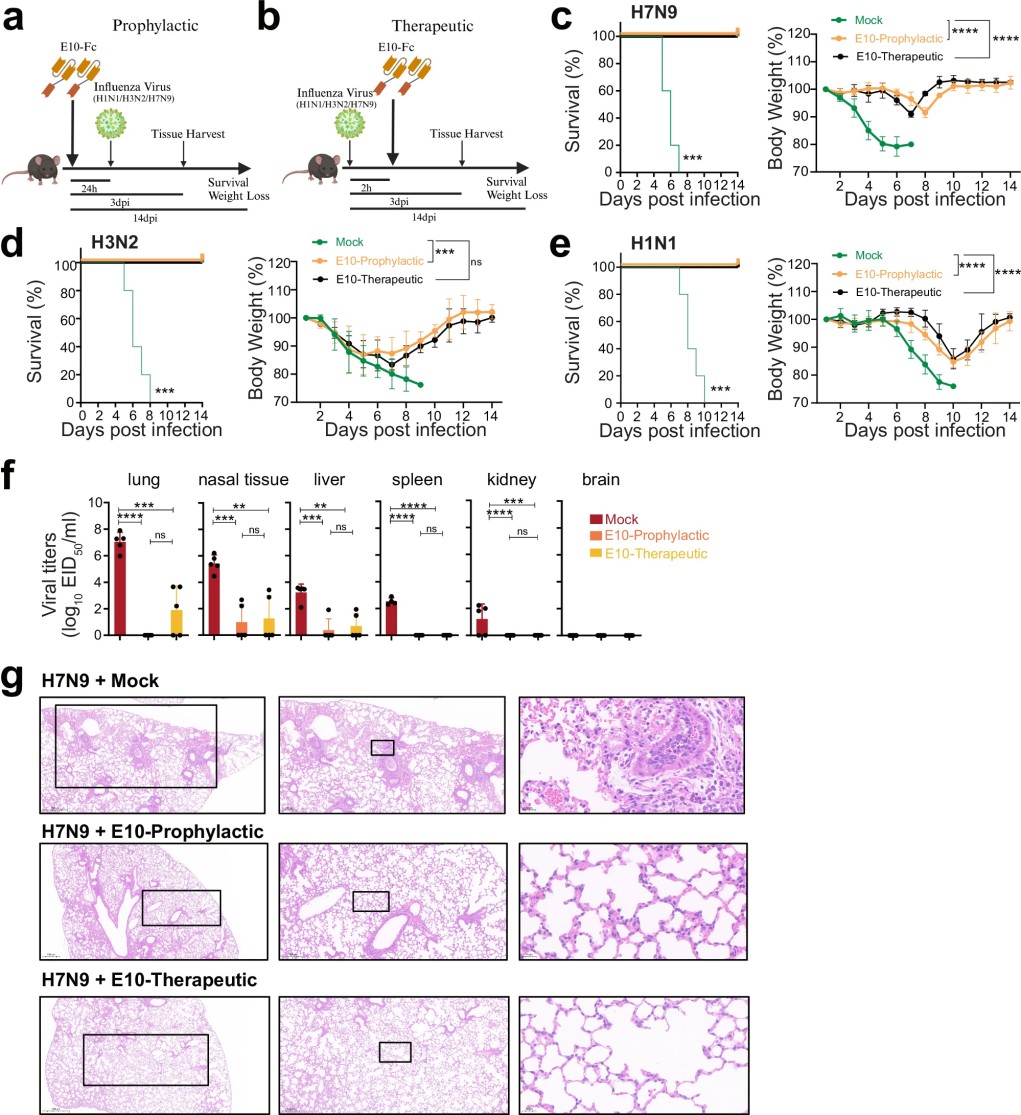
图2. E10 治疗可保护小鼠免受同亚型和异亚型流感病毒(IAV)攻击。
a, b. 体内研究的实验设计示意图:小鼠腹腔注射(i.p.)E10-Fc或PBS后,感染流感病毒(H1N1、H3N2或H7N9)。
c–e. Kaplan–Meier生存曲线与体重监测:小鼠在感染H1N1(3 × 10³ TCID50)、H3N2(10⁷ TCID50)或H7N9(10⁶ EID50)后,接受E10-Fc或PBS作为预防或治疗,并在感染后14天内监测体重。
f. 病毒滴度测定:在SZ19 H7N9感染3天后,检测六个器官(肺、鼻组织、肝、脾、肾、脑)中的病毒滴度(EID50),并比较是否接受E10治疗的情况。
g. 组织病理学分析:在H7N9感染3天后,取小鼠肺组织进行组织病理学分析,并比较E10治疗组、PBS对照组和MOCK组的病理变化。刻度条: 500 μm(左)、200 μm(中)、20 μm(右)。
病毒逃逸突变体及耐药性的适应性代价
然而,研究人员也意识到,病毒可能会随着时间的推移对 E10 产生抗性。因此,他们进行了实验,反复让 H7N9 病毒暴露于 E10,并观察是否会出现逃逸突变(Escape Mutants)。最终,病毒在 HA 蛋白的 K166T 和 S167L 位点发生突变,从而逃脱了 E10 的结合。但值得注意的是,这些突变使病毒付出了代价——突变病毒的生长速度显著下降,在细胞培养中表现出更弱的复制能力,并且在小鼠体内的感染能力也有所减弱。这表明 E10 靶向的 HA 侧斑区域对于病毒至关重要,即使病毒发生突变,它可能也会因此失去适应性。这一发现增强了科学家们对E10 作为长期抗流感策略的信心。
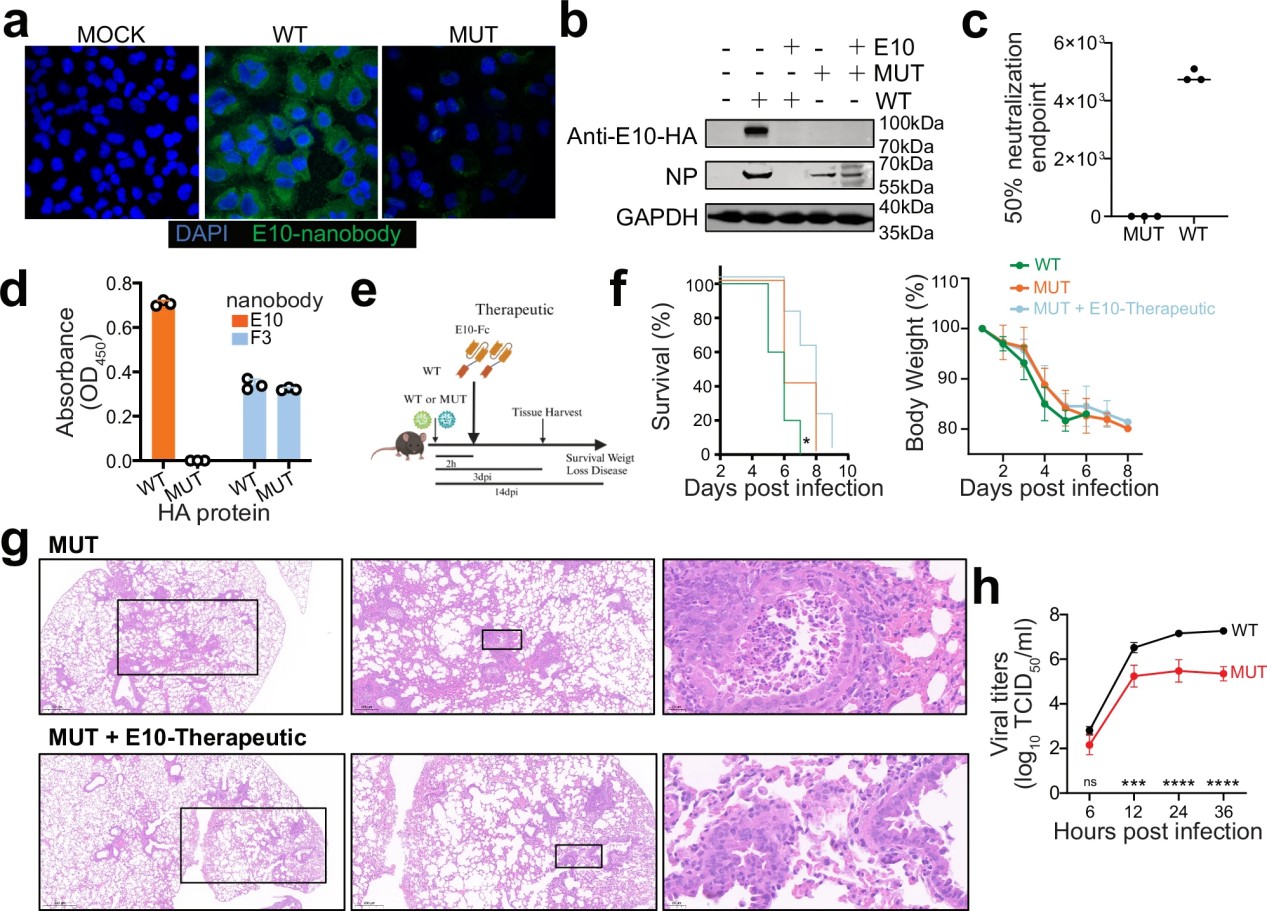
图3. H7-HAK166T、S167L双突变体可逃避免 E10 识别,但病毒适应性降低。
a. 免疫荧光实验(IFA):A549细胞感染野生型(WT)或突变型(MUT)H7N9病毒(MOI=0.1),24小时后使用E10作为一抗,并加二抗(羊抗人IgG Fc Alexa Fluor™ 488)进行染色。细胞核用DAPI(蓝色)染色,NP纳米抗体检测信号显示为绿色。
b. Western Blot(WB)分析:A549细胞感染WT或MUT H7N9病毒,并检测NP蛋白和E10纳米抗体的结合情况,其中部分样本在感染前预先孵育E10。
c. 50%中和终点检测:通过血凝实验检测E10对WT和MUT病毒的50%中和终点,测量病毒子代凝集红细胞(RBCs)的能力。
d. ELISA检测:采用ELISA方法,使用E10和F3纳米抗体检测WT-HA和MUT-HA血凝素(HA)蛋白的结合情况。
e. 体内实验方案:设计并绘制体内实验流程(详见f、g)。
f. Kaplan–Meier生存曲线与体重监测:小鼠腹腔注射(i.p.)E10-Fc或PBS(参考e),随后感染WT(10⁶ EID50)或MUT病毒(10⁶ EID50),监测感染后14天的体重变化,并绘制Kaplan–Meier生存曲线。
g. 组织病理学分析:H7N9突变病毒感染3天后,对小鼠肺组织进行组织病理学分析,并比较E10治疗组与对照组的病理变化。刻度条: 500 μm(左)、200 μm(中)、20 μm(右)。
h. 病毒生长动力学:在MDCK细胞中感染WT或MUT病毒(MOI=0.001),分别在感染后6、12、24、36小时收集上清,并使用TCID50测定病毒滴度。
E10 表位的免疫优势性及疫苗潜力
研究人员进一步探索了 E10 结合位点是否可以成为疫苗靶点。他们发现,在感染野生型 H7N9 的小鼠体内,近 50% 的生发中心 B 细胞(GC B 细胞)和几乎所有记忆 B 细胞都针对 E10 识别的 HA 侧斑表位。而在感染携带 K166T/S167L 突变的病毒的小鼠中,这种免疫反应大幅减弱,进一步证实了免疫系统天然地优先识别该区域。为了验证该表位是否可以作为疫苗靶点,研究人员设计了一种基于 H7HA166-186 表位的多肽疫苗,并在小鼠体内进行了实验。接种该疫苗后,小鼠产生了能够识别 H7、H1 和 H3 的交叉反应抗体。这些抗体不仅能够有效阻断病毒血凝作用(HAI),而且当小鼠随后受到 H7N9 致死剂量攻击时,它们表现出部分保护作用。虽然多肽疫苗的免疫原性通常较低,但该实验结果仍然证明了 E10 表位作为通用疫苗靶点的潜力。
这项研究的发现,为开发广谱流感治疗和疫苗提供了重要的新思路。E10 不仅表现出对多种流感亚型的强效保护,其靶向的表位也足够保守,有望成为未来疫苗设计的基础。尽管仍然存在挑战,比如如何优化疫苗配方以诱导更持久和更强的免疫反应,但本研究为下一代抗流感治疗奠定了基础。随着 H5N1 和 H7N9 等流感病毒不断对全球构成潜在威胁,像 E10 这样的工具可能在未来流感大流行爆发前发挥关键作用。
小结:迈向广谱流感防护的一步
本研究强调了 E10 作为流感 A 病毒治疗及疫苗靶点的潜力。
- E10 是一种广谱中和纳米抗体,能够结合 HA 头部的保守表位,阻断病毒附着和进入细胞。
- E10 可保护小鼠免受多种流感亚型(H7N9、H1N1、H3N2)的感染,并能在体内降低病毒载量。
- 虽然病毒可以产生逃逸突变,但这些突变体的病毒适应性降低,表明 E10 结合的表位在病毒功能上具有重要性。
- 该表位表现出较强的免疫优势性,并且针对该位点的肽疫苗接种可提供部分保护,支持其作为广谱流感疫苗靶点的潜力。
在新的流感威胁不断出现的背景下,E10 及其靶向表位代表了迈向通用流感防护的重要一步,为未来疫苗和抗病毒治疗带来了希望。