高亲和力F5纳米抗体的发现
在宫颈癌的发展机制中,E6/E7蛋白通过降解p53等抑癌蛋白来促进肿瘤发展,由于其为胞内蛋白,使得传统抗体难以靶向。但E6蛋白的某些片段,如E629-38和E711-19可通过主要组织相容性复合体I类(MHC-I,即HLA-A*02:01)呈递至细胞表面,因此该pMHC恰好成为了纳米抗体的理想靶点。
为了筛选出高亲和力的纳米抗体,研究团队通过免疫骆驼并提取了外周血单核细胞(PBMCs)构建了噬菌体展示文库,以E629-38与pMHC的复合物为靶标,通过多轮结合-洗脱-扩增,富集特异性克隆筛选出F5和G9两个纳米抗体。
通过ELISA与BLI测定发现两个纳米抗体均对E6-pMHC复合物有特异性结合能力,亲和力与多数TCR(天然T细胞受体)接近。在通过流式细胞检测后显示,F5与细胞表面E6-pMHC复合物的结合效率显著高于G9,且F5对CaSki和SS4050细胞有高结合力,呈剂量依赖性,无明显脱靶结合。这一发现为进一步的研究提供了良好前提。
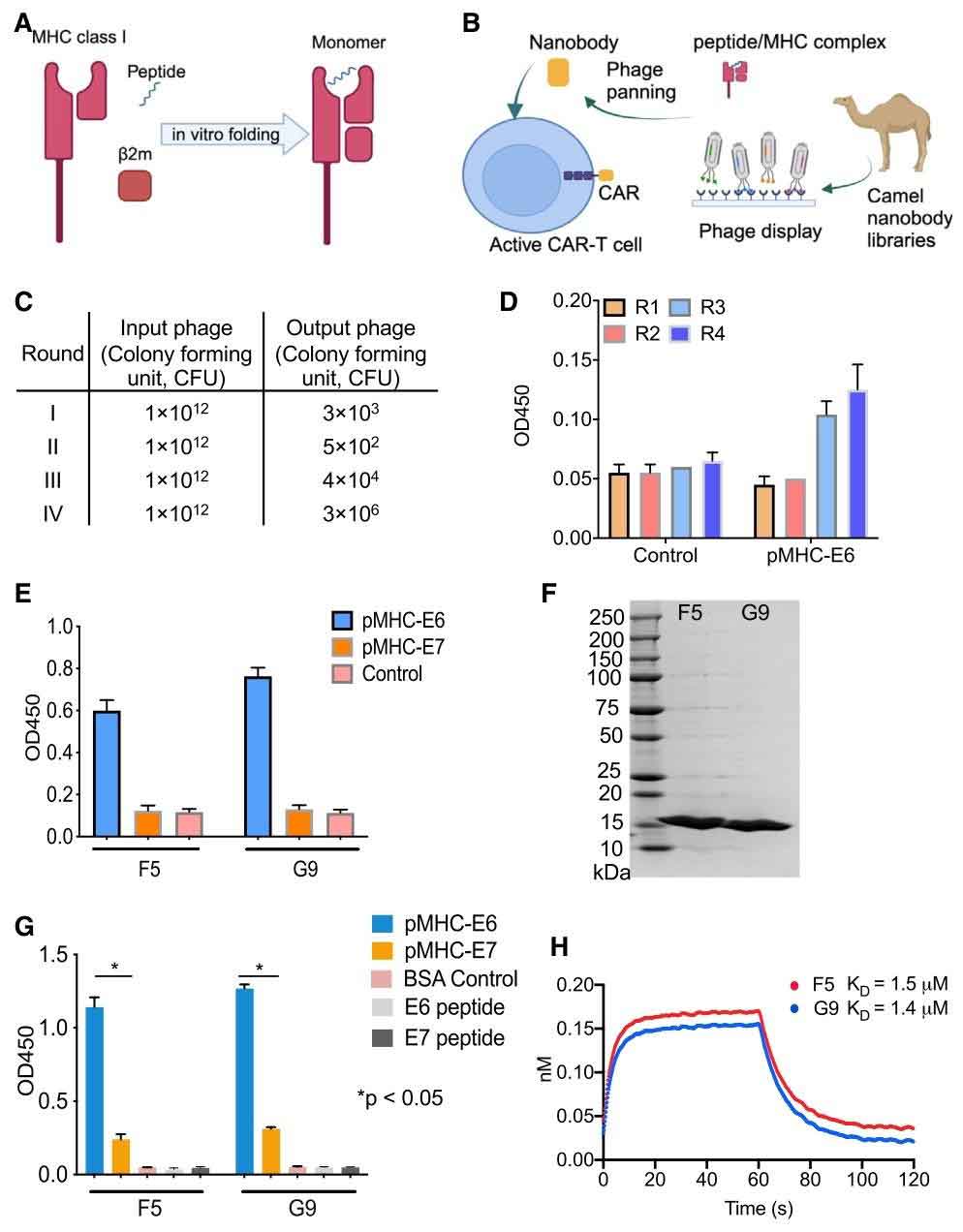
图1:通过噬菌体展示技术筛选靶向E6-pMHC的纳米抗体
F5 CAR-T细胞:体外高效杀伤与体内抑瘤
为了最大化激活T细胞的杀伤能力与持久性,研究团队将F5纳米抗体整合至第二代CAR结构中,其抗原识别域以F5纳米抗体直接靶向E6-MHC复合物;铰链与跨膜区采用CD8α分子,确保CAR-T锚点的稳定性与信号传递功能;共刺激域引入4-1BB(CD137),通过激活NF-κB通路延长T细胞存活时间并抑制其衰亡进程;激活域依赖 CD3ζ 链触发 T 细胞杀伤信号级联反应;安全开关则通过截短的 EGFR来实现体内追踪与可控清除。
体外实验显示,F5 CAR-T细胞对HPV-16宫颈癌细胞展现出精准且高效的杀伤能力。其特异性识别E6-pMHC复合物阳性细胞(如 293E6、CaSki、SS4050),在效靶比(E:T)为12.5:1时对CaSki细胞的杀伤率超60%,显著优于传统TCR-T疗法(同等条件下杀伤率仅30%)。共培养实验证实,F5 CAR-T通过释放IL-2、IFN-γ、颗粒酶A/B等效应分子,激活NFAT和NF-κB双信号通路,但未引发过度炎症反应。
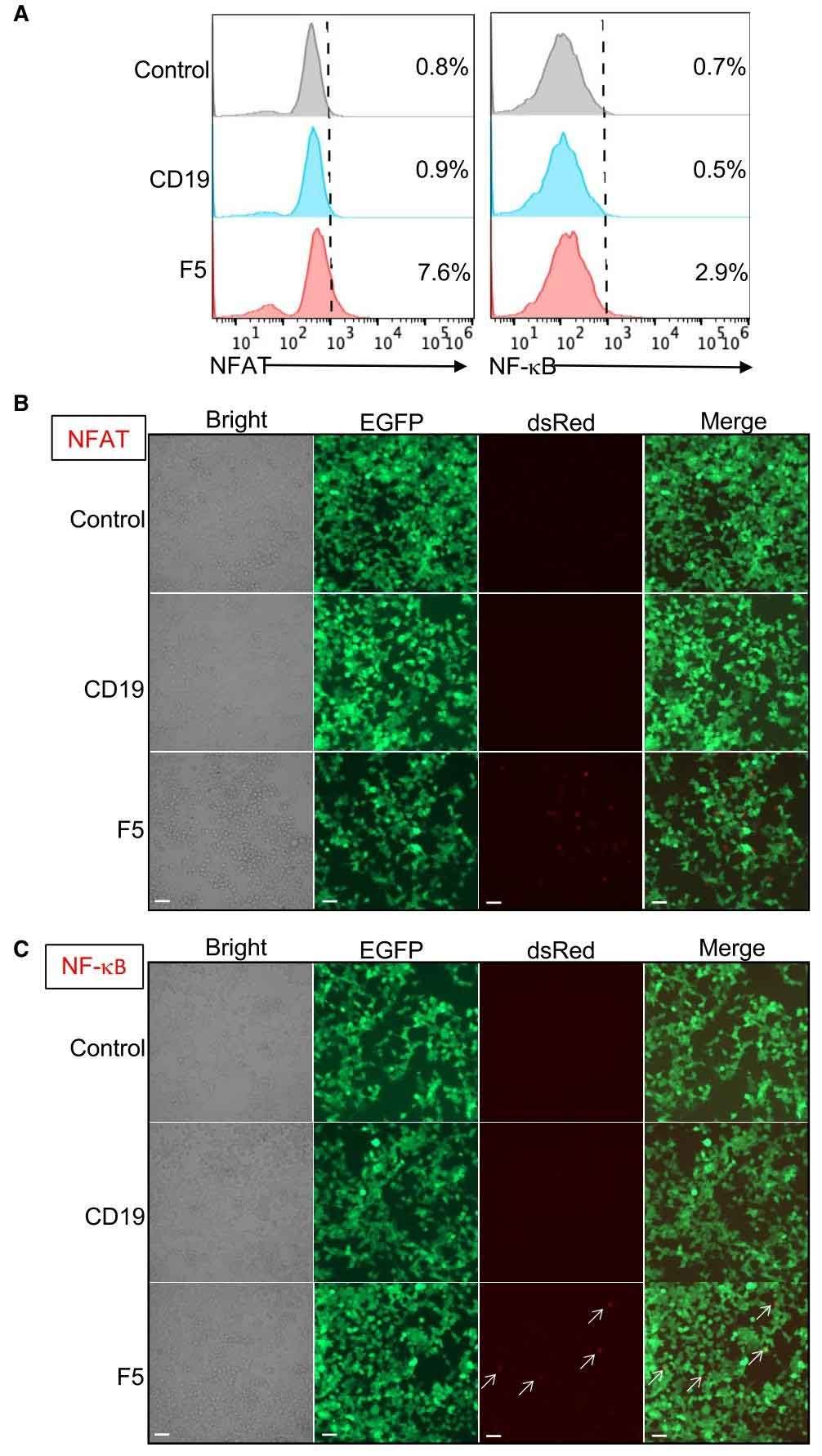
图2:NFAT 和 NF-κB 均参与基于 F5 的 CAR-T 细胞激活
在小鼠模型中,F5 CAR-T的疗效与安全性得到验证:单次静脉输注后,治疗组肿瘤体积较对照组(CD19 CAR-T或未改造T细胞)缩小 70%,有效性持续至治疗后第7周。治疗6周后,脾脏分离的CAR-T细胞仍保留杀伤活性,且未观察到体重下降或器官病理损伤,证明其低脱靶毒性与优异安全性。这一设计为HPV相关实体瘤的精准治疗提供了创新策略。

图3:F5 CAR-T细胞对HPV16+宫颈癌细胞的特异性杀伤及细胞因子释放谱
机制解析:F5 纳米抗体的精准识别与 HLA 限制性突破
进一步研究中,研究团队通过系统性丙氨酸扫描技术揭示F5纳米抗体结合的核心区域为肽段C端的第5、6、9位残基(Ile、Leu及Val),其中任何一个位点的突变均导致结合完全丧失,而第8位(Glu)突变仅部分降低亲和力。值得注意的是,第2、4、7位残基的突变虽不影响F5结合,但会破坏pMHC对肽段的稳定呈递,表明这些位点对复合物构象至关重要。
分子对接模拟显示,F5纳米抗体的FR2与CDR3协同嵌入HLA分子的α螺旋沟槽,其中CDR3直接接触肽段C端,而FR2与HLA的保守区域形成氢键网络。这种结合模式与天然TCR高度相似,提示F5纳米抗体可模拟T细胞的免疫识别过程。
然而,F5的pMHC限制性限制了其广泛应用。研究团队提出多维度解决方案:首先开发双特异性纳米抗体,同时靶向E6肽段与HLA的保守区域(如β2微球蛋白),实现跨HLA亚型识别;其次通过基因编辑技术构建通用型CAR-T(UCAR-T),敲除患者T细胞的HLA基因并引入通用CAR,避免免疫排斥;此外联合使用E629-38肽段疫苗增强患者自身免疫应答,与CAR-T形成协同效应。
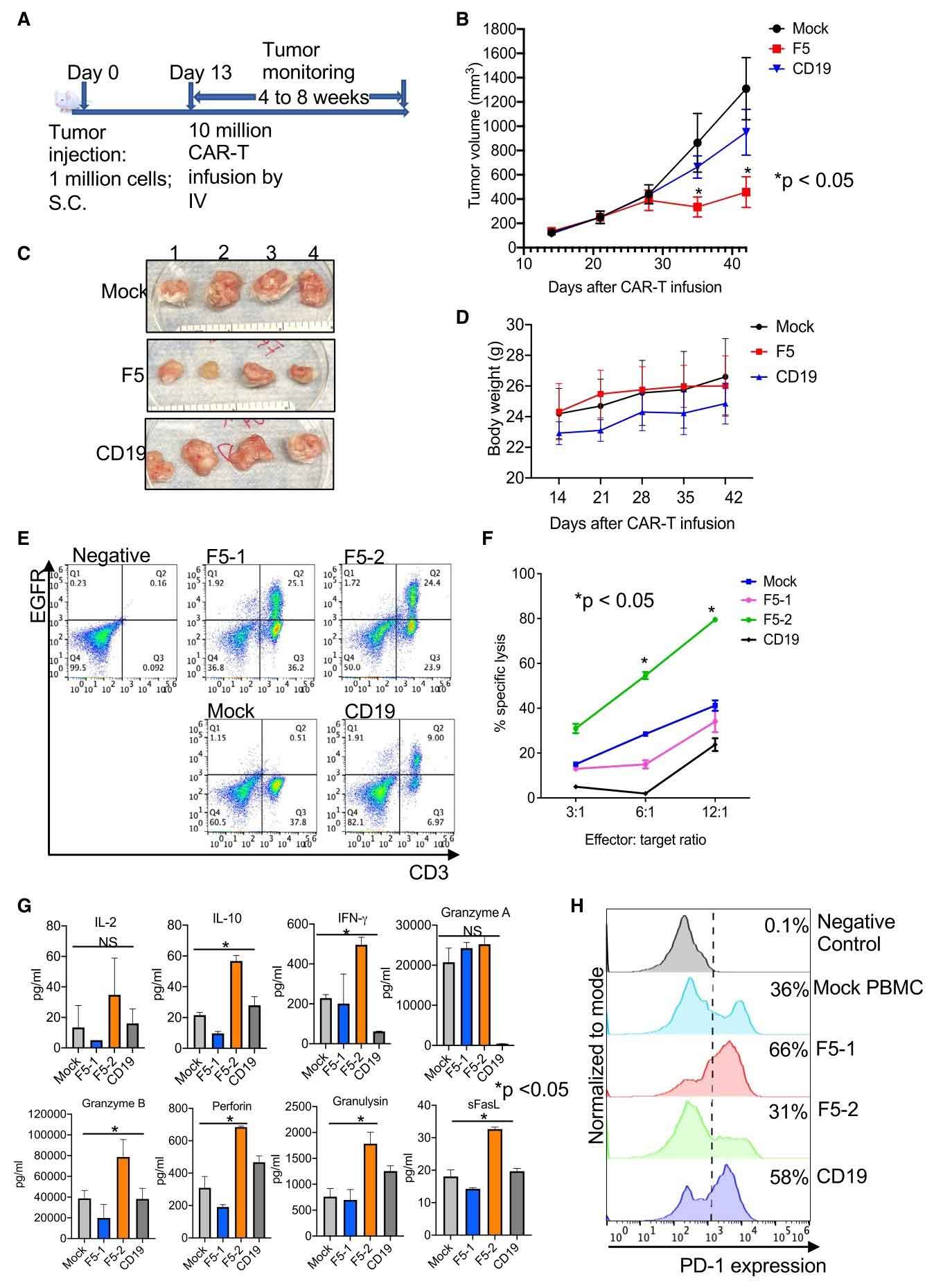
图4: F5 CAR-T 在宫颈癌小鼠模型中的抗肿瘤效果及持久性分析
研究总结及未来方向
总的来说,TCR模拟抗体(TCRm)与CAR-T的结合是癌症免疫治疗技术的创新升级。TCRm的高亲和力可结合pMHC隐蔽表位,减少脱靶效应,还可同时激活双信号通路,持续刺激T细胞活化并明显增强针对肿瘤细胞的杀伤能力,且毒副作用更低,安全性得到显著增强;同时,纳米抗体小分子体积的优势能克服实体瘤微环境,提升CAR-T在实体瘤细胞中的穿透能力,TCRm的引入使CAR-T能够靶向E6-pMHC复合物,解决了传统抗体无法触及细胞内抗原的难题。
F5纳米抗体的成功不仅为宫颈癌患者带来希望,更标志着纳米抗体技术在癌症治疗领域的全面突破,有望成为对抗癌症、病毒感染等重大疾病的“万能钥匙”。研究团队也表明在未来将聚焦于结构优化与临床转化:通过冷冻电镜(Cryo-EM)解析F5与 E6-pMHC复合物的高分辨率结构,指导纳米抗体的人源化改造以降低免疫原性;同时探索与PD-1抑制剂联用,逆转肿瘤微环境中的T细胞耗竭,推动F5 CAR-T疗法的临床应用。
参考文献:Duan, Z. et al. (2024). CAR-T cells based on a TCR mimic nanobody targeting HPV16 E6 exhibit antitumor activity against cervical cancer. Molecular Therapy: Oncology.

纳博生命现拥有覆盖抗体开发到抗体发现,再到抗体工程的全链路技术平台。其中包括噬菌体展示、大肠杆菌展示、哺乳动物细胞展示等筛选平台,膜蛋白制备及mRNA免疫平台。通过多平台的交叉互补为药企及科研院所提供灵活的抗体发现及改造服务,助力药物试剂的研发。
纳博生命专注于纳米抗体开发、改造与应用,拥有符合实验动物标准的羊驼繁育基地与独立实验基地。致力于构建产、学、研一体化的实验公共服务平台。希望能为广大生物科研机构、医药研发企业和创新团队提供更专业、性价比更高的实验服务。
更多服务内容,请关注纳博生命公众号或拨打官方电话400-822-9180进行咨询!