高倍瞄准镜:纳米抗体
传统AAV靶向策略主要依赖衣壳蛋白的工程化改造,例如插入短肽或化学连接靶向配体,但这些方法存在局限性。短肽与受体的结合亲和力较低导致靶向性不足,而传统抗体分子体积大则会导致病毒衣壳组装和感染能力下降。
为解决这一难题,研究人员由德国与法国的多个研究团队联合发表于Cell子刊的研究《Nanobody-Enhanced Targeting of AAV Gene Therapy Vectors》指出:将纳米抗体插入AAV衣壳蛋白VP1的特定区域,可实现对多种膜蛋白的高效靶向,并可将纳米抗体拓展至不同AAV血清型,为基因治疗的精准化铺平道路。

纳米抗体出于分子体积小的优势,易于插入AAV病毒衣壳且不影响其结构。在此基础上,纳米抗体可同时发挥可精准识别复杂膜蛋白的构象表位能力,使得这种嵌合体可实现让AAV“指哪打哪”的精准靶向能力。
研究方法与突破性成果
在靶点选择中,研究团队选择了AAV2衣壳蛋白VP1的GH2/GH3环作为插入位点,该区域是衣壳表面最突出的部分,且在此前已有研究证实此区域可以容纳如mCherry荧光蛋白等大分子蛋白。
在确认插入位点后,研究团队将GH2/GH3环的7个氨基酸(453-459位)替换为110-130个氨基酸的纳米抗体,并突变邻近GH12/GH13环的R585和R588为丙氨酸,消除AAV2与肝素硫酸蛋白聚糖(HSPG)的非特异性结合,通过双质粒共转染系统,确保病毒仅包含纳米抗体-VP1融合蛋白,避免未修饰衣壳蛋白的干扰。这种改造在Western blot检测中证实纳米抗体成功整合到AAV2衣壳中,且病毒产量未受显著影响。
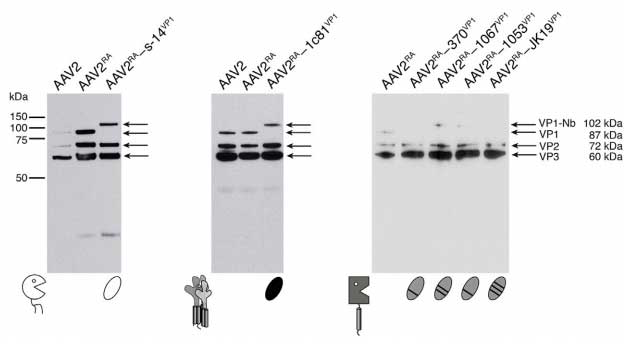
成功整合到AAV2衣壳中的纳米抗体
在靶向效率的验证过程中,研究团队使用稳定表达CD38、ARTC2.2、P2X7三种膜蛋白的HEK细胞作为靶细胞模型,通过流式检测AAV与靶细胞的结合特异性。结果发现,纳米抗体修饰的AAV2(AAV2<sup>RA</sup>)对靶细胞的结合效率显著提升;携带GFP报告基因的AAV2<sup>RA</sup>在靶细胞中的转导效率提升10-500倍(图4),其中P2X7靶向效果最佳(>500倍)。
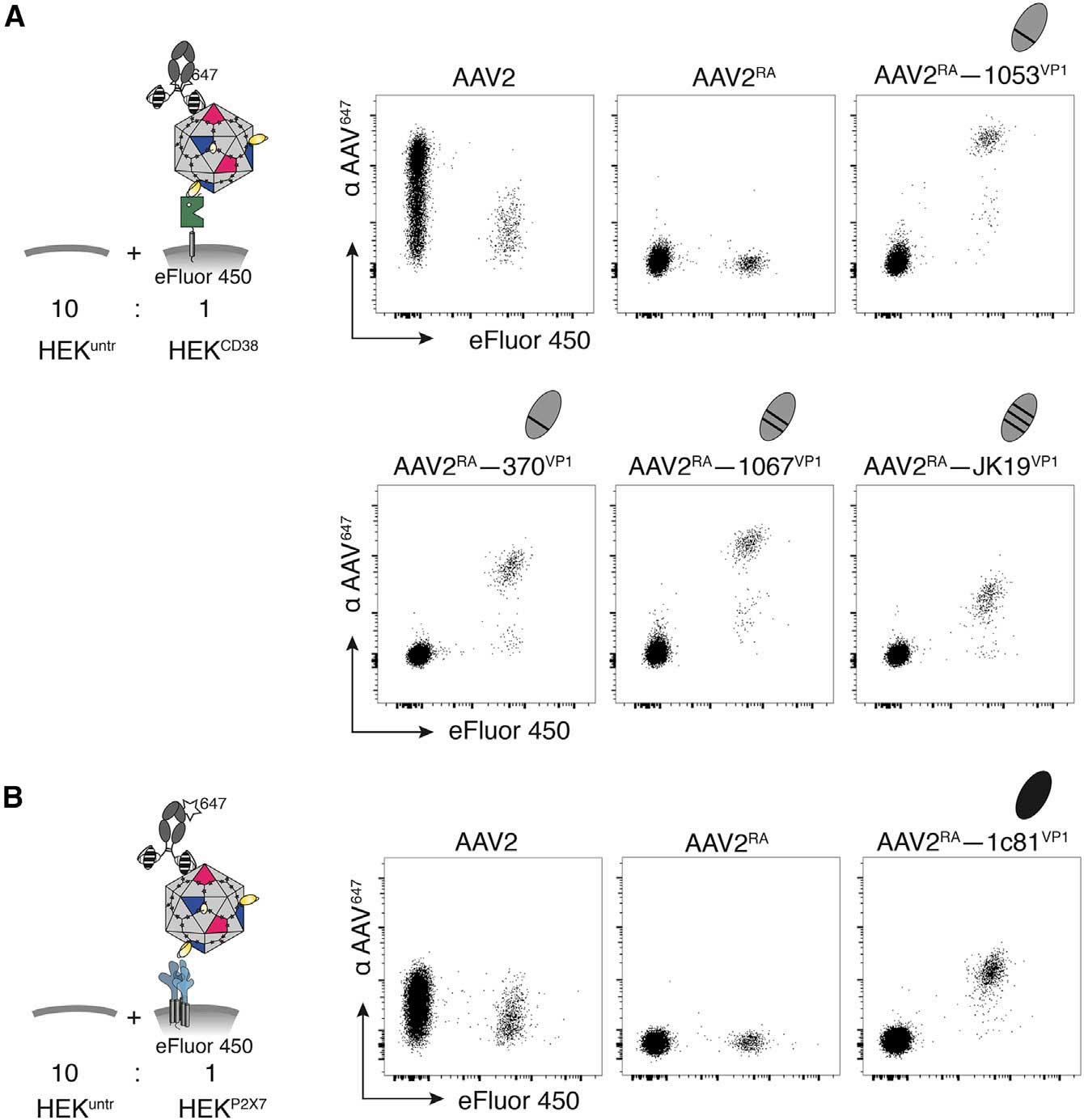
纳米抗体嵌入AAV衣壳蛋白后可介导其靶向能力
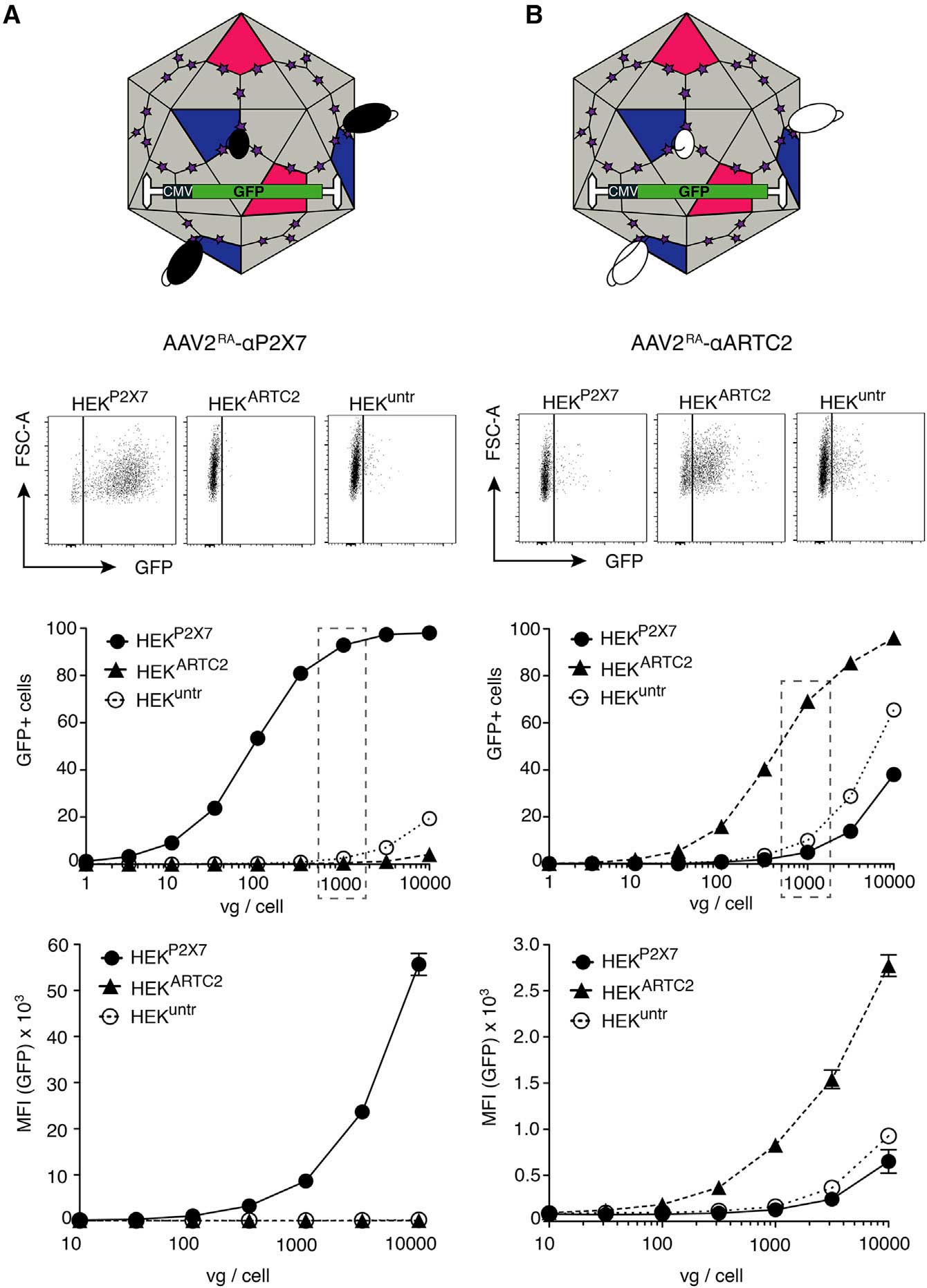
嵌入纳米抗体后的AAV靶向能力得到了极大提升
跨血清型兼容性的“导航革命”
目前已发现有十余种可靶向不同组织的AAV血清型,又由于AAV本身的“广谱趋向性”的特性,使其在既往靶向性研究中的难度有了更大的加成。
为了突破困境,研究团队将AAV2的VP1-纳米抗体融合蛋白整合到其他血清型(AAV1、AAV8、AAV9)的衣壳中,形成“马赛克AAV”,同时通过引入提前终止密码子,抑制宿主血清型VP1的表达,确保仅整合AAV2的修饰VP1。
结果显示马赛克AAV成功靶向CA46人B细胞淋巴瘤、Yac-1小鼠T细胞淋巴瘤及多发性骨髓瘤患者原代骨髓细胞等多种细胞。靶向效率与母体血清型相当,且脱靶率极低。这一跨血清型兼容性的研究结果为靶向难题提供了新的研究策略。
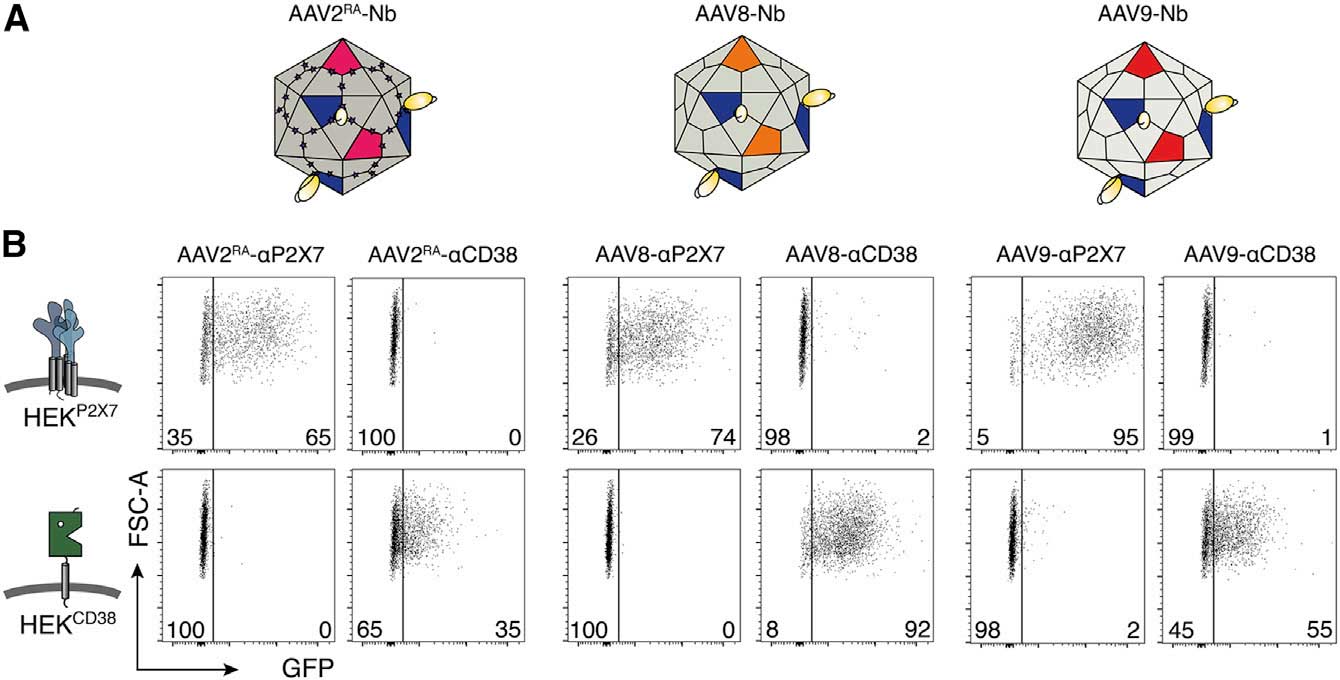
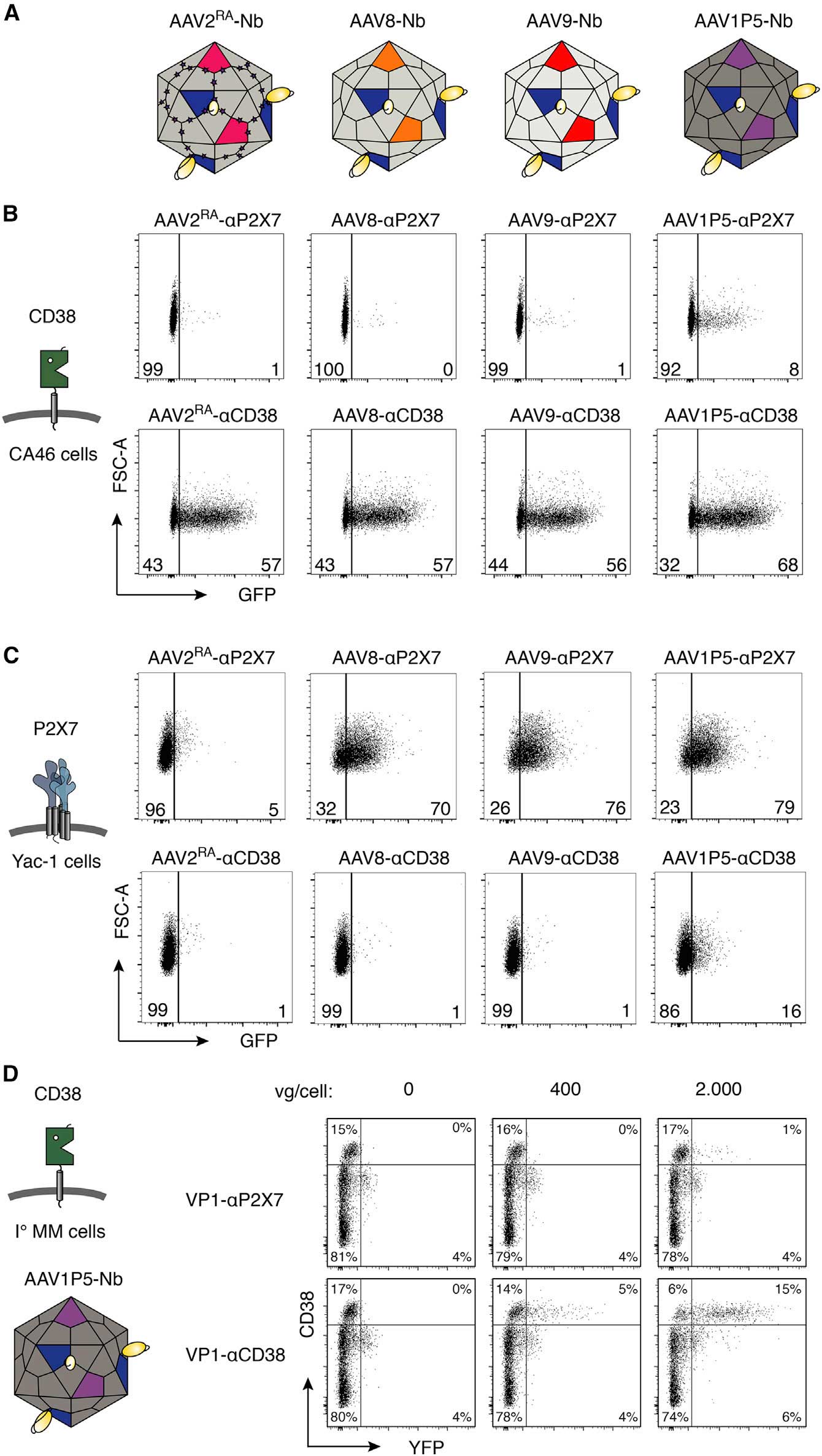
整合后的融合蛋白可以使AAV8/9的靶向能力重新定向且能特异性地增强对靶蛋白细胞的转导
该研究证实将纳米抗体插入AAV衣壳蛋白,并通过N端长连接肽和C端短连接肽的设计,确保抗原结合区朝外,可有效提升靶向效率。在跨血清型的改造策略上,同样可成功靶向离子通道、跨膜蛋白和GPI锚定蛋白,证明其对复杂膜结构的识别能力,大幅减少AAV“广谱趋向性”带来的限制。这一技术不仅突破了传统AAV的靶向瓶颈,还为个性化医疗提供了新工具。







