纳米抗体偶联物的设计与机制
MNB-Pyra Nbs由靶向模块、光敏模块及自报告模块三个部分组成。靶向模块:研究团队将7D12纳米抗体通过甲酰甘氨酸生成酶(FGE)在纳米抗体C端引入醛基标签(fGly)形成靶向模块7D12-fGly,用于特异性偶联;杀伤模块:将吗啉修饰的尼罗蓝结构连接吡唑啉酮,通过ROS可裂解硫缩酮连接臂共价连接后形成I型光敏剂MNB-Pyra。其中MNB的苯并吩噻嗪结构属于在光激发后能通过电子转移高效产生超氧自由基(O₂⁻),以克服肿瘤缺氧限制达到治疗作用;自报告模块:ROS响应性硫缩酮连接臂,光照后裂解并释放单体光敏剂,伴随荧光恢复以实现自报告。
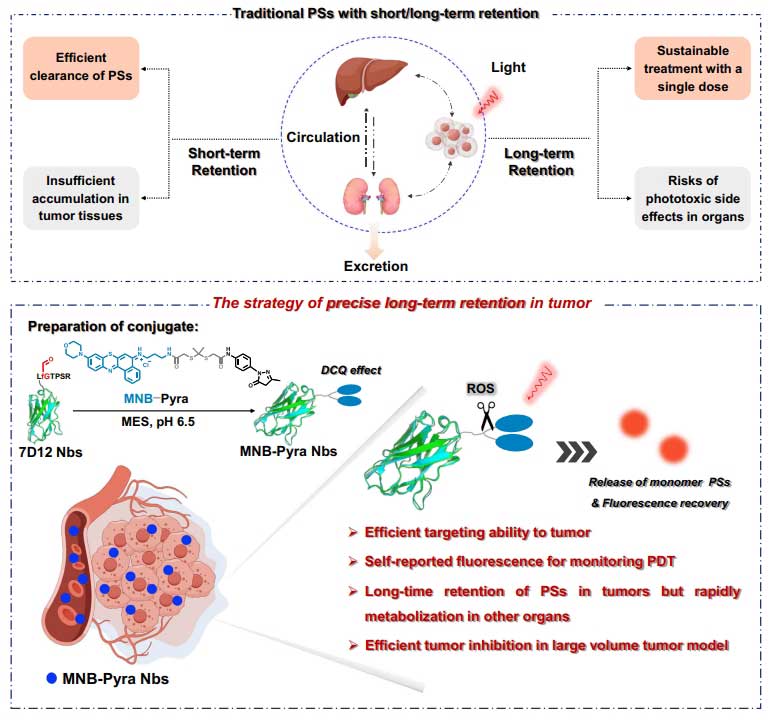
MNB-Pyra Nbs结构与作用机制
研究团队将7D12-fGly纳米抗体与MNB-Pyra以1:2的比例特异性偶联,质谱验证显示偶联效率超95%,且不影响抗体亲和力(Kd=24.33 nM)。通过SDS-PAGE和HPLC-HRMS等技术表征确认了偶联物的成功合成,每个7D12-fGly 纳米抗体均成功偶联两个 MNB-Pyra 分子。
偶联后,7D12-fGly纳米抗体能够特异性结合EGFR配体的结合结构域III,并随后被细胞内吞;MNB-Pyra则在光照后通过电子转移高效产生超氧自由基(O₂⁻),发挥光动力治疗作用。由于偶联之后的MNB-Pyra分子因π-π作用堆积形成二聚体,并呈现一种独特的自猝灭特性,荧光量子产率从4.6%降至0.8%,且在630 nm光照下可触发ROS裂解连接臂,并释放出单体光敏剂而恢复荧光效果,荧光恢复强度与ROS生成量正相关,可实时反馈治疗效果。
高效性与安全性的双重验证
为了进一步确认MNB-Pyra Nbs的治疗能力与安全性。研究人员选用了四种EGFR表达水平不同的细胞系进行实验。结果显示,MNB-Pyra Nbs对EGFR阳性的A431和HeLa细胞具有高度选择性,细胞摄取效率高,而在EGFR表达极低的A549和NIH-3T3细胞中摄取极少。这表明MNB-Pyra Nbs能够精准靶向EGFR高表达的癌细胞。
在光动力治疗效果方面,MNB-Pyra Nbs在常氧和缺氧条件下对 A431细胞均展现出强大的光毒性。常氧条件下,其半最大抑制浓度 (IC50)为0.2μM;在模拟肿瘤缺氧微环境(2%O2)中,IC50为0.4μM,依然能有效杀伤细胞。通过活/死细胞成像、伤口愈合实验和细胞凋亡检测等多种实验进一步证实,MNB-Pyra Nbs在光动力治疗后能够高效杀死癌细胞,抑制EGFR高表达细胞的增殖和侵袭,并诱导细胞凋亡。同时,在治疗过程中,MNB-Pyra Nbs 表现出自我报告能力,光照后细胞内荧光显著增强,反映出单体光敏剂的释放和ROS的产生。这些数据表明其性能显著优于传统光敏剂。
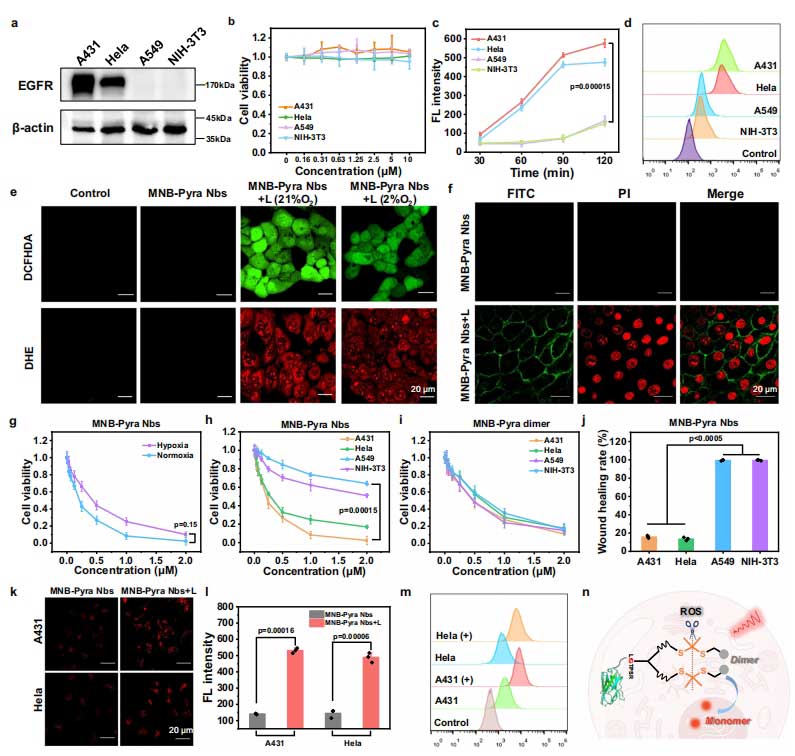
MNB-Pyra Nbs的靶向成像、自报告及光动力治疗效果
在动物实验中,MNB-Pyra Nbs同样表现出优异的治疗能力和安全性。在荷瘤裸鼠模型中,通过静脉注射后约4小时可达到荧光信号的峰值,且具有精准聚集、长时间滞留的特性。在未进行光照时,MNB-Pyra Nbs不会被激活,且会在24小时内被快速代谢出体外;而光照后释放的单体光敏剂则通过疏水作用,主要滞留于肿瘤细胞溶酶体上,持续作用5天。在对于初始体积约350mm3的大体积肿瘤治疗实验中,结果显示单次光动力治疗效果不明显,但连续进行三次光动力治疗后,MNB-Pyra Nbs的肿瘤抑制率超过95%,部分肿瘤甚至完全消失。组织学分析显示广泛凋亡(TUNEL阳性率85%)和增殖抑制(Ki-67表达下降90%)。
治疗期间小鼠体重稳定,心、肝、脾等主要器官无病理损伤,未光照组器官中无药物蓄积,进一步证实了MNB-Pyra Nbs在体内的生物相容性和安全性。
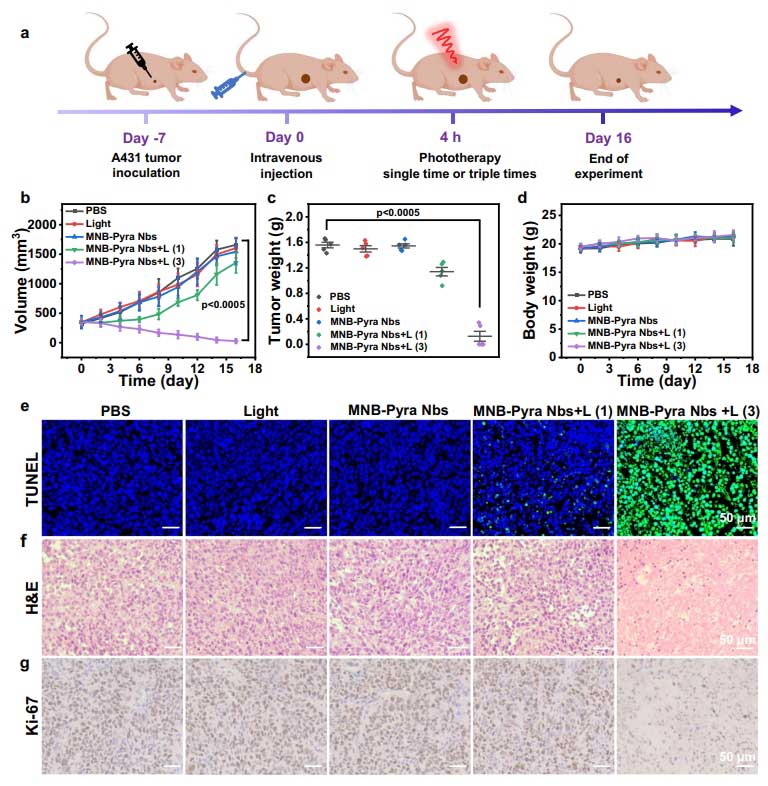
MNB-Pyra Nbs在荷瘤裸鼠模型中的光动力治疗效果
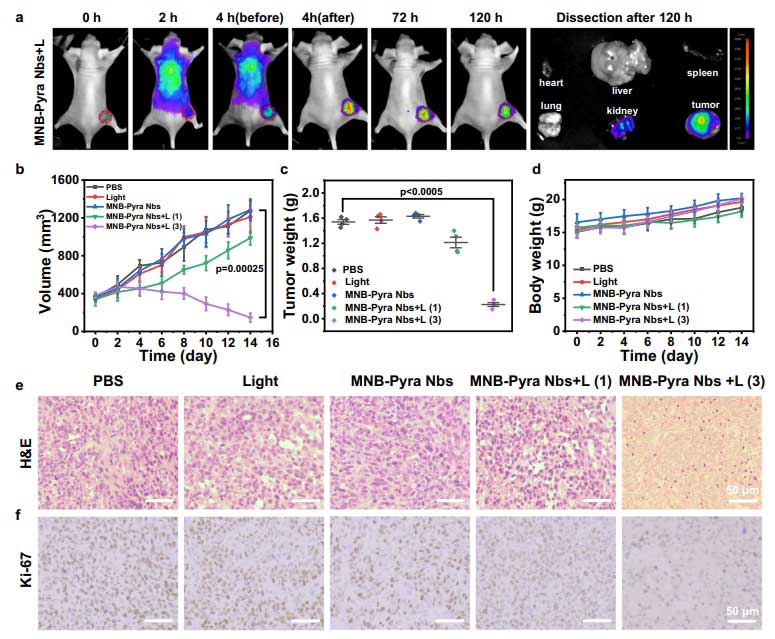
MNB-Pyra Nbs在大体积肿瘤模型中的光动力治疗效果
从科学突破到临床治疗的展望
与传统肿瘤治疗方法及其他光动力疗法相对比,基于纳米抗体的偶连物MNB-Pyra Nbs显示出的优势极为明显,其治疗能力、安全性、持续性及治疗成本均显著高于其他疗法,并具有临床转化的优势。如通过替换靶向模块即可扩展至乳腺癌、肺癌等领域;单次给药支持多次治疗,减少患者住院频次;荧光自报告功能可辅助医生动态调整光照方案等。且纳米抗体本身具有易生产、成本低的特点,使其在研发及生产成本上也显著优于传统的单克隆抗体,无疑在总体成本上给患者带来了极大程度的便利性。总而言之,MNB-Pyra Nbs的诞生不仅为光动力疗法注入新活力,更为实体瘤治疗提供了可推广的范式。随着技术的不断优化,纳米抗体有望成为精准医疗领域的通用工具并造福全球患者。
参考文献:Chen, Y., Xiong, T., Peng, Q. et al. Self-reporting photodynamic nanobody conjugate for precise and sustainable large-volume tumor treatment. Nat Commun 15, 6935 (2024). https://doi.org/10.1038/s41467-024-51253-5