IL-17A和IL-17F共同形成的同源二聚体(IL-17A/A、IL-17F/F)与异源二聚体(IL-17A/F)均可引发并维持炎症反应。传统单克隆抗体多数仅靶向IL-17A,无法有效阻断IL-17F介导的炎症通路,导致部分患者疗效不佳。由瑞士生物制药企业MoonLake Immunotherapeutics研发的纳米抗体药物Sonelokimab(SLK)是一种新型三结构域纳米抗体,其三个VHH结构域可分别高亲和力地结合IL-17A、IL-17F以及人血清白蛋白。这种设计使其能同时阻断由IL-17A和IL-17F形成的所有三种二聚体(A/A,A/F,F/F)所介导的信号传导。临床数据显示,其诱导的PASI 90(皮损几乎完全清除)应答率显著高于传统单靶点药物;尤其对于中重度银屑病(基线PASI≥10)患者,SLK 120 mg WI组在第24周时PASI 100(皮损完全清除)应答率高达57.1%,充分印证了其双靶点抑制的卓越优势。
与传统单克隆抗体(约150kDa)相比,Sonelokimab分子量仅约40kDa,不足前者的1/3。其小分子特性使其能够更轻松地穿透血管壁及组织屏障,直达关节滑膜、肌腱等低血管化炎症部位。同时,其第三个VHH结构域可特异性结合人血清白蛋白。由于炎症组织局部血管通透性增加,白蛋白会大量渗出并富集,该结构能有效引导Sonelokimab在炎症部位靶向聚集,从而进一步提升局部药物浓度并延长其半衰期。临床前研究(如小鼠胶原诱导关节炎模型)已证实,与白蛋白结合的纳米抗体在炎症关节中的积累量显著高于非结合型纳米抗体及传统单抗,为该药的增强疗效提供了坚实的机制支撑。
近期,由MoonLake资助英国格拉斯哥大学、美国华盛顿大学等多所知名高校及医疗机构共同参与的一项全球性、随机、双盲、安慰剂对照的II期临床试验(ARGO研究)结果公布,证实了Sonelokimab在PsA治疗中显著的疗效与良好的安全性。
试验设计与患者基线
该研究在保加利亚、德国、美国等8个国家的42个临床中心开展, 2022年12月至2023年5月期间筛选265例患者,最终207例符合条件的活动性银屑病关节炎患者被随机分配至5个治疗组,分别为Sonelokimab 120mg每4周一次(含诱导期,WI)、60mg每4周一次(含诱导期)、60mg每4周一次(无诱导期,NI)、安慰剂组(PBO)及阿达木单抗对照组(ADA,40mg每2周一次)。
患者纳入标准为年龄≥18岁的存在活动性银屑病或有明确银屑病病史,同时确诊为PsA,且PsA疾病活动度评估标准中压痛关节数≥3、肿胀关节数≥3的患者;排除标准包括既往使用过2种以上生物制剂、对IL-17或TNF抑制剂治疗失败等。基线时,各治疗组患者特征均衡,49.3%为女性,17.4%曾使用过生物制剂,71.0%同时使用甲氨蝶呤(MTX),关节、皮肤病变等疾病严重程度无显著差异,为后续疗效对比奠定公平基础。
关节与皮肤功能双重改善
在关节症状改善方面,治疗第12周时,Sonelokimab 60 mg WI组与120 mg WI组的ACR50应答率分别达到46.3%和46.5%,显著高于安慰剂组的20%(P<0.05, P<0.01);60 mg NI组为36.6%,与安慰剂组的差异未达统计学显著性(P=0.086)。疗效持续至第24周时,Sonelokimab各剂量组的ACR50应答率进一步提升至58.1%~61.0%。此外,从第12周由安慰剂切换至SLK 120 mg NI治疗的患者,其ACR50应答率在第24周时升至54.1%,而阿达木单抗组为54.8%,充分体现了Sonelokimab对关节炎症的持续控制作用。
在皮肤症状改善方面,第12周时,Sonelokimab 60 mg WI组与120 mg WI组的PASI 90应答率分别高达76.9%和59.3%,均显著优于安慰剂组的15.4%(P<0.001, P=0.003)。至第24周,SLK各组的PASI 100(皮肤完全清除)应答率最高达到63.0%。特别值得注意的是,由安慰剂切换至SLK治疗的患者,其PASI 100应答率从第12周的15.4%大幅跃升至第24周的75.0%,展现出SLK强大的皮肤病变清除能力。
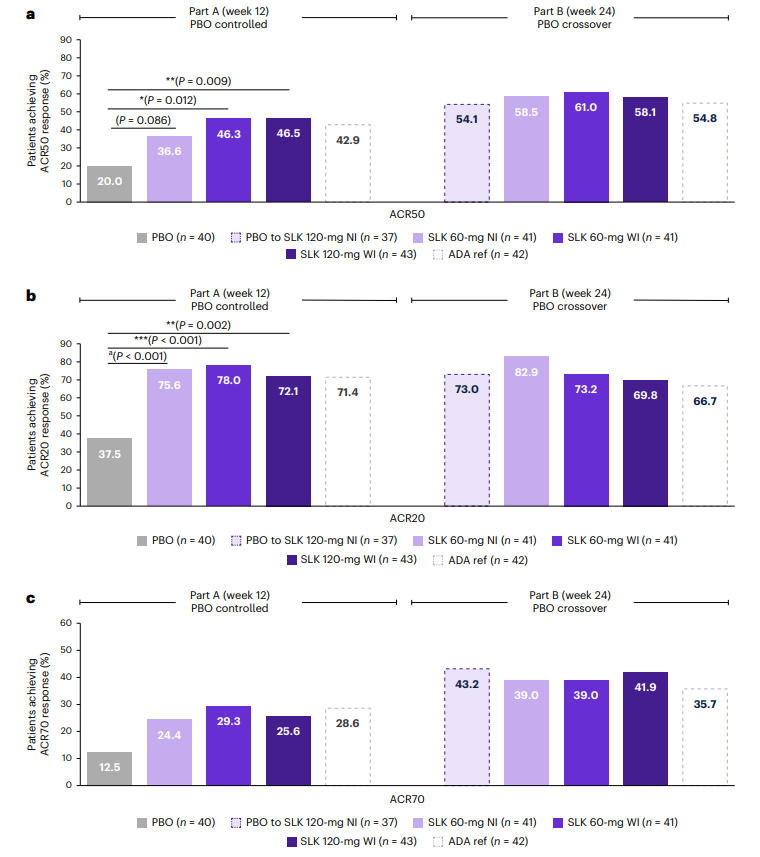
图1:第12/24周各治疗组ACR20/50/70应答率
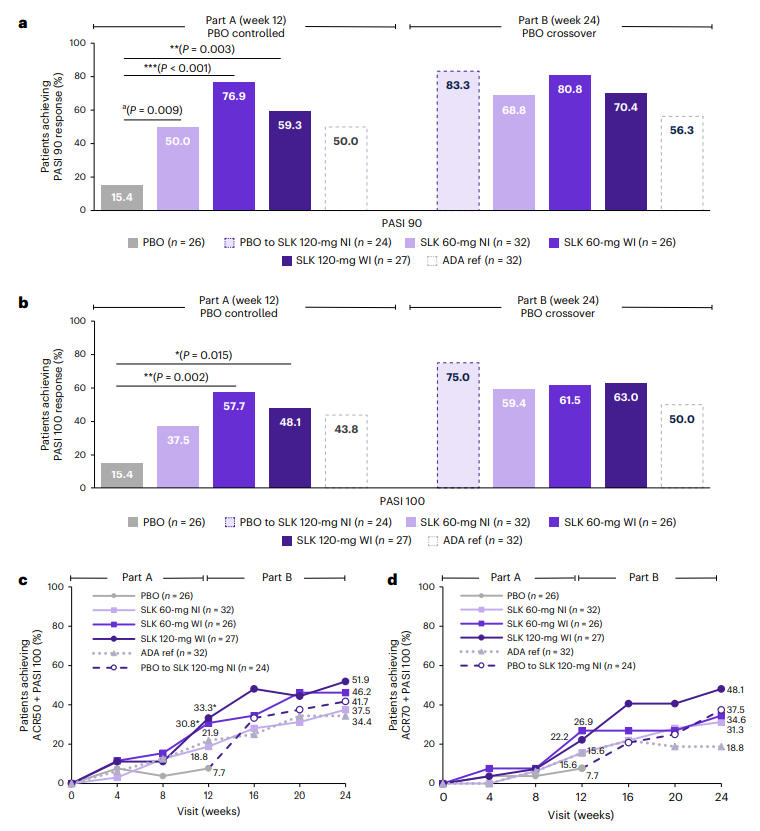
图2:第12/24周各治疗组PASI 90/100应答率
多领域疗效与安全性
在复合终点方面,第24周时,Sonelokimab 120 mg WI组同时达到ACR70与PASI 100的患者比例高达48.1%。此外,SLK 60 mg WI组实现最小疾病活动度(MDA)的患者比例达到61.0%,显著优于安慰剂(第12周时为20.0%)。患者报告结局(如PsAID-12、疼痛评分、健康评估问卷HAQ-DI)亦显示出显著改善,且在女性、超重、合并使用甲氨蝶呤等关键亚组中疗效保持一致,体现了其广泛的适用性。
安全性方面,Sonelokimab耐受性良好。最常见治疗期间不良事件为鼻咽炎(60 mg组6.1%、120 mg组5.2%)、上呼吸道感染(60 mg组6.1%、120 mg组4.1%),仅报告4例轻度至中度口腔念珠菌感染(2.1%-2.4%)。研究中未观察到炎症性肠病(IBD)、主要不良心血管事件(MACE)等与传统IL-17抑制剂相关的特殊关注不良事件,其安全性特征良好。
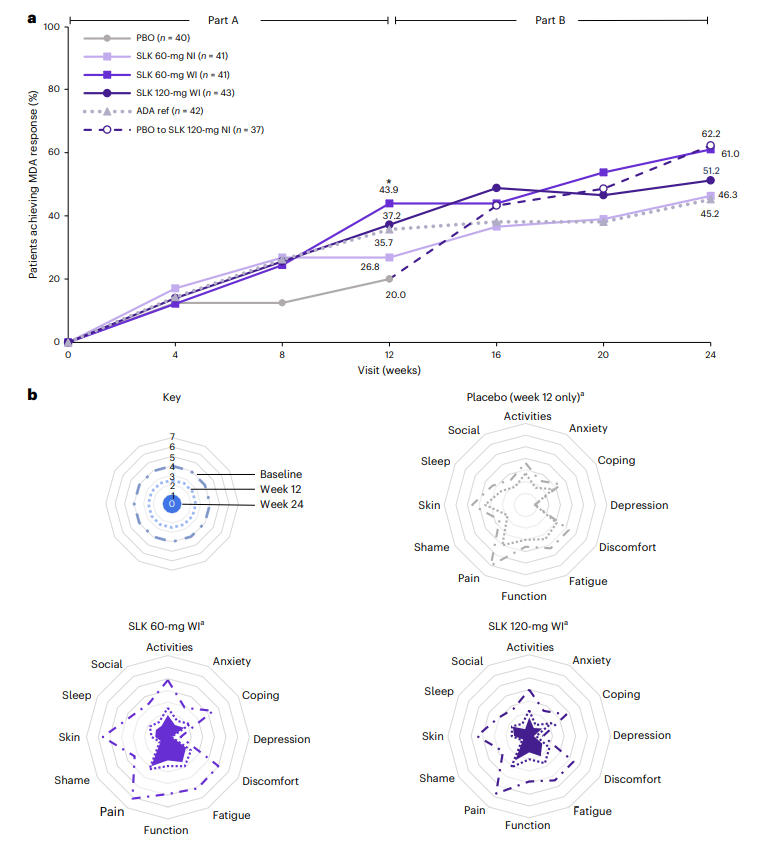
图3:第24周各治疗组达到MDA的患者比例及患者报告结局
推动多种自身免疫性疾病的纳米抗体研究
Sonelokimab的II期临床试验不仅证实了其在PsA治疗中的卓越疗效与良好安全性,更展示了纳米抗体作为一种新型治疗模式的巨大潜力。其双靶点抑制、优异组织渗透性与模块化设计,为未来自身免疫疾病的治疗提供了新思路。
除银屑病关节炎外,Sonelokimab的研究策略可快速拓展至其他IL-17介导的自身免疫性疾病治疗领域中。目前,针对IL-17A及IL-17F的靶点研究已在强直性脊柱炎、类风湿关节炎、特应性皮炎等疾病领域中开展,并获得了良好的阶段性研究成果。以强直性脊柱炎为例,约有四成患者存在轴向炎症,Sonelokimab的双靶点阻断机制在PsA患者的治疗中已显示出对轴向症状的改善作用,为抗IL-17A/F药物在强直性脊柱炎治疗研究中提供了理论基础。此外,该策略对合并多种IL-17相关疾病的患者具有独特优势,或可实现“一药多治”的简化治疗方案,极大程度地提升了患者依从性。

武汉纳博生命科技有限公司是由武汉产业创新发展研究院牵头成立建设的纳米抗体产业平台。其总部位于武汉东湖新技术开发区武创院本部大楼,在武汉生物城精准医疗产业基地拥有占地面积达1400㎡的自主实验室,并在武汉左岭与黄冈团风分别建立了符合实验动物标准的羊驼实验基地与转运基地,目前基地在饲养的羊驼共600余头,可为科研机构及抗体药物研发企业提供“零免疫背景”保障的羊驼免疫服务。
纳博生命专注于纳米抗体开发、改造与应用,致力于构建产、学、研一体化的实验公共服务平台。现拥有从抗原制备(多肽、蛋白及RNA),到抗体发现和抗体工程,再到生物学功能验证/筛选的全链路技术平台。其中RNA抗原包括针对羊驼进行RNA结构和序列优化的RNA;抗体发现与抗体工程服务采用噬菌体展示、RNA以及哺乳动物细胞展示在内的多种技术路线。通过多平台的交叉互补为药企及科研院所提供灵活的抗体发现及改造服务,助力药物试剂的研发。
除纳米抗体天然文库外,纳博生命科技还推出了现货免疫库,帮助客户快速筛选符合需求的抗体分子。
联系方式:400-822-9180 丨 联系邮箱:marketingdept@nanobodylife.com