近年来,大规模深度测序和结构生物学技术,特别是冷冻电镜(cryo-EM)的突破,为基于结构的药物研发提供了强大助力。LGR4 (Leucine-rich repeat-containing G protein-coupled receptor 4)因其在能量代谢和脂肪褐变中的关键作用,被遗传学研究证实为潜在的抗肥胖靶点。然而,由于其胞外结构域(ECD)表面特征,开发传统小分子拮抗剂面临巨大挑战。
在此背景下,由上海交通大学医学院附属瑞金医院、中国科学院上海药物研究所等机构联合开展的一项研究,成功解析了LGR4及其配体复合物的三维结构,并开发出一种能特异性阻断LGR4信号通路的纳米抗体NB21,为肥胖治疗提供了全新的解决方案。该研究成果已发表于国际权威期刊《Nature Communications》。
该研究成功解析了全长LGR4及其与RSPO2(FU)复合物的冷冻电镜结构,并筛选出能阻断LGR4与RSPO1/2结合的抑制性纳米抗体 NB21,并明确其复合物结构。NB21融合鼠IgG2 Fc段(NB21-mFc)在体外和体内均表现出显著抑制Wnt/β-catenin信号通路,增强米色脂肪细胞产热和线粒体呼吸,在体内促进白色脂肪棕色化,显著提升能量消耗,对高脂饮食和遗传型(ob/ob)肥胖均展现出显著的减重效果,为肥胖治疗提供了全新的靶向候选药物及结构基础。
LGR4及相关复合物的冷冻电镜结构解析
研究团队首先针对 LGR4 结构解析的技术瓶颈,设计了高亲和力纳米抗体NB52,并与幽门螺杆菌HopQ蛋白的胞外粘附结构域融合扩展为MB52,其作为结构研究的辅助工具,主要用于增大LGR4复合物的颗粒尺寸和优化取向。借助MB52的辅助,成功获得分辨率3.03Å的全长LGR4结构,其胞外域呈180度延伸弯曲的马蹄形,相对于膜层呈直立构象,7次跨膜结构域则与非活性状态的A 类GPCR结构相似。
为探究配体结合对LGR4构象的影响,团队进一步解析了LGR4与RSPO2(FU 结构域)复合物的冷冻电镜结构,分辨率达3.06Å。结果显示,LGR4与RSPO2(FU)以1:1比例结合,RSPO2通过FU2结构域结合于LGR4胞外域顶部的凹面,主要作用于LRR3-LRR7重复序列,通过盐桥、氢键及疏水作用形成稳定相互作用界面,掩埋约2200.96 Ų的溶剂可及表面积。对比发现,RSPO2结合仅使LGR4胞外域发生2.5度轻微旋转,未诱导其向活性构象转变。
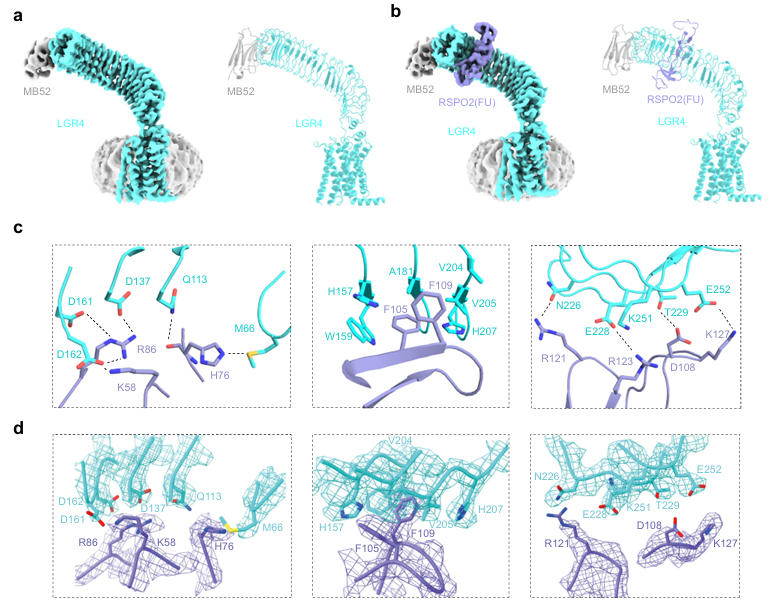
图1:LGR4及其与RSPO2(FU)复合物的冷冻电镜结构
抑制性纳米抗体NB21的筛选与结构鉴定
基于LGR4靶向纳米抗体噬菌体展示文库,研究团队通过TOPFlash实验筛选出具有显著抑制活性的纳米抗体NB21。BLI实验证实,NB21对人LGR4胞外域的解离常数(KD)为1.12±0.04nM,对鼠LGR4的KD为0.82±0.01nM,亲和力高且具有种属交叉反应性,能有效竞争RSPO1/2与LGR4的结合位点。
随后,团队解析了LGR4-NB21复合物的冷冻电镜结构(分辨率 3.64Å),发现NB21通过互补决定区(CDRs)结合于LGR4胞外域上部凹面,掩埋约2260.04Ų的溶剂可及表面积,其结合表位与RSPO1/2在LGR4上的结合位点高度重叠,这是NB21阻断配体结合的结构基础。进一步分析显示,NB21的K31与LGR4的D137、D161形成盐桥,Y32与D162形成氢键,R100与E228形成盐桥,这些关键相互作用残基在人鼠LGR4中完全保守,确保了其功能稳定性。
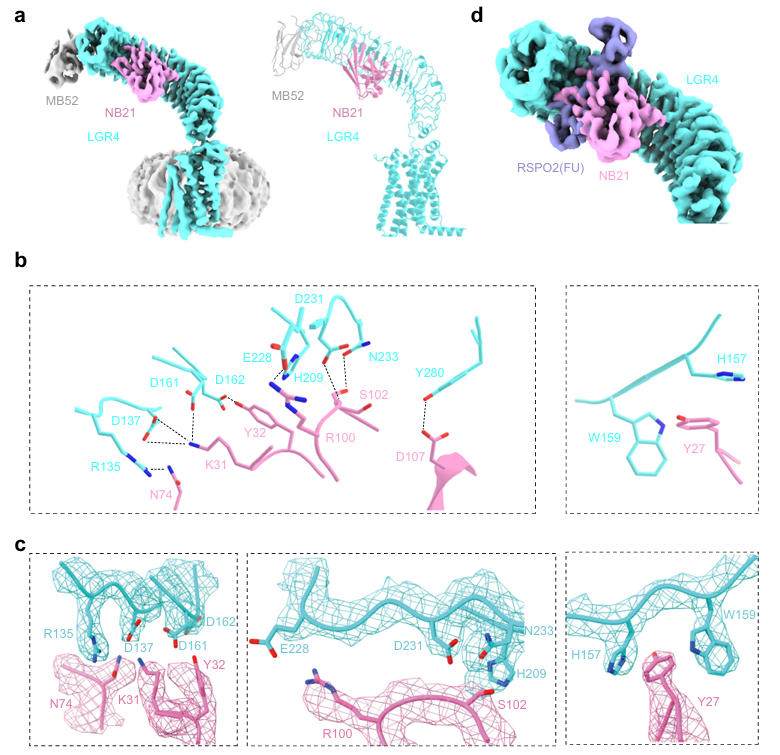
图2:LGR4-NB21复合物的结构分析
NB21-mFc的体外功能验证
为提升NB21的体内半衰期和生物利用度,研究团队构建了NB21-mFc融合蛋白。在体外实验中,用RSPO1处理小鼠皮下白色脂肪组织基质血管组分(SVFs),会导致活性β-连环蛋白水平升高、核内积累增加,并激活经典Wnt信号通路靶基因;而加入NB21-mFc后,上述效应被显著抑制。
在米色脂肪细胞中,NB21-mFc以剂量依赖方式阻断RSPO1/2诱导的经典Wnt信号通路激活,同时上调产热基因的表达,增强线粒体呼吸功能,表明其能有效逆转RSPO1/2对米色脂肪产热的抑制作用,促进白色脂肪向棕色脂肪转化。
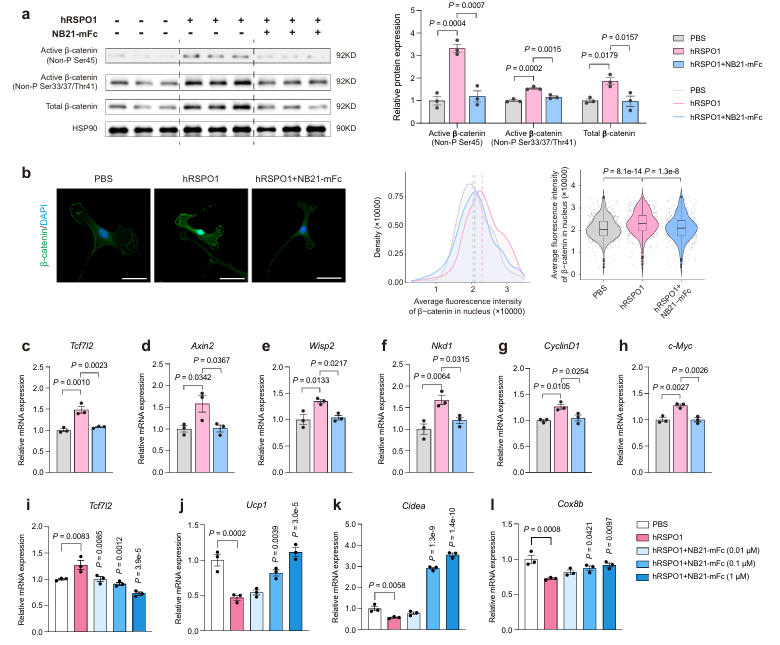
图3:NB21-mFc抑制Wnt信号通路并促进米色脂肪细胞转化
NB21-mFc的体内抗肥胖效果验证
为确认NB21-mFc在体内的抗肥胖效果,研究团队对饮食诱导的肥胖(HFD)小鼠模型采用0.2mg/kg,隔日一次,持续6周的方案进行腹腔注射NB21-mFc。经观察发现,NB21-mFc能显著减少野生型(WT)小鼠的体重增加和脂肪量,尤其是内脏白色脂肪组织(vWAT)和皮下白色脂肪组织(sWAT)重量降低,脂肪细胞体积减小,UCP1蛋白表达升高。代谢监测显示,NB21-mFc处理组小鼠能量消耗(EE)显著增加,并在急性和慢性冷暴露中增强产热能力。
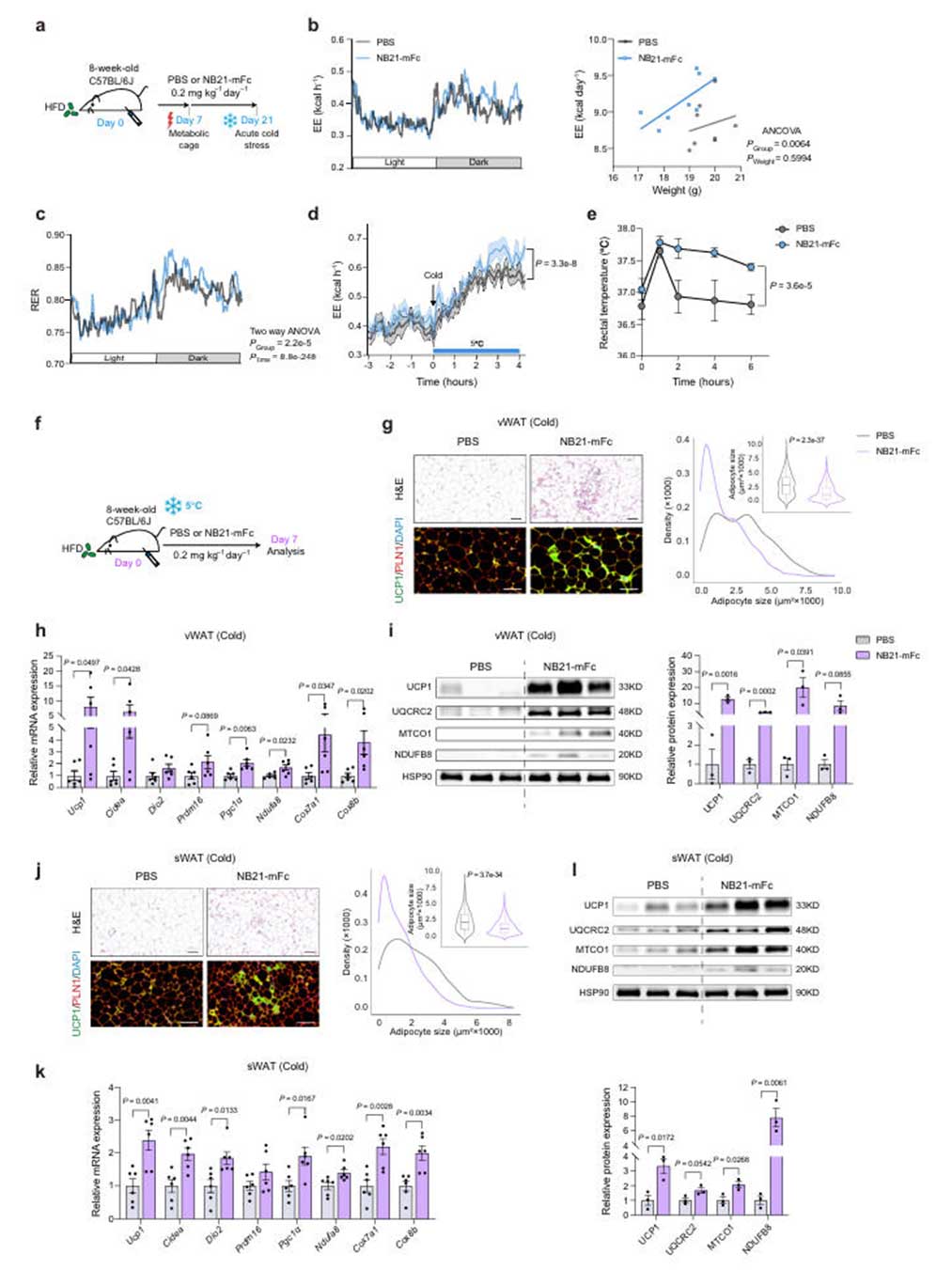
图4:NB21-mFc增强能量消耗与冷诱导产热
在Lgr4基因敲除(Lgr4m/m)小鼠模型中,NB21-mFc促进产热和减轻肥胖的效果完全消失,表明其作用机制高度依赖于LGR4。尽管NB21可能与其他LGR家族成员(如LGR5/6)存在交叉反应,但通过基因敲低实验证实,NB21-mFc的代谢效益主要由LGR4介导。
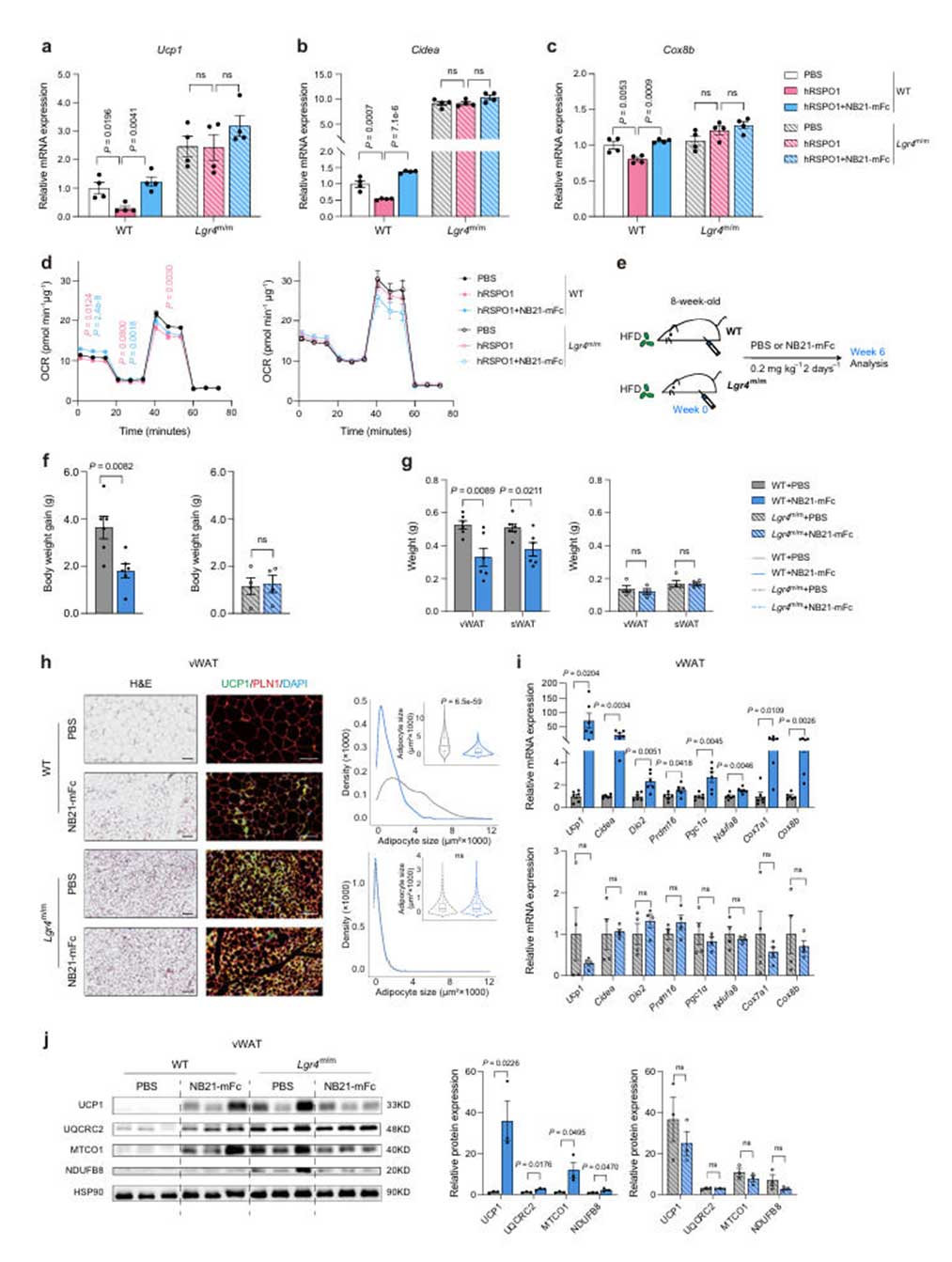
图5:NB21-mFc通过LGR4依赖性机制促进脂肪褐变
在Leptin缺陷型(ob/ob)肥胖小鼠模型中,低剂量NB21-mFc处理即可显著降低体重、脂肪质量,并提高能量消耗。组织学与分子分析显示,其脂肪组织中UCP1表达上升,炎症因子水平下降,进一步支持其在严重肥胖模型中的治疗潜力。
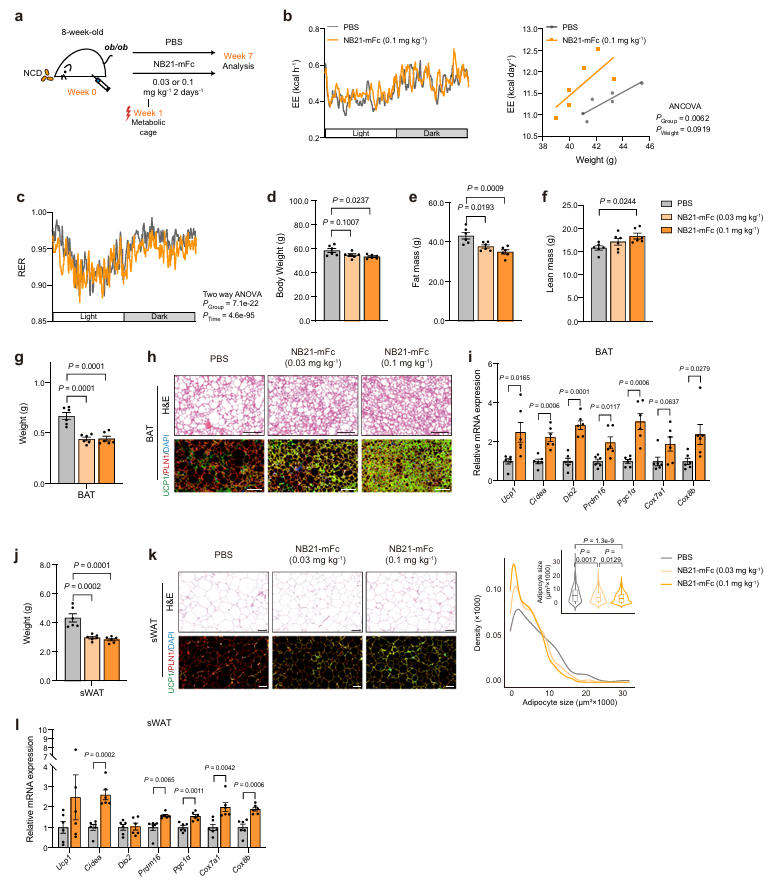
图6:NB21-mFc在ob/ob小鼠中的抗肥胖效果
该研究不仅揭示了LGR4及其配体复合物的精细结构,还为肥胖治疗领域增添了一个新的靶点,更成功开发出具有治疗潜力的纳米抗体NB21,其在多个肥胖模型中表现出显著的减重能力,并有望成为下一代抗肥胖药物的重要候选,为全球肥胖患者带来新的希望。且该研究由我国科研团队主导,解析了关键靶点的核心结构,开发了具有自主知识产权的候选药物,提升了在该领域的国际竞争力,为我国生物医药产业的创新发展注入新动力。

武汉纳博生命科技有限公司是由武汉产业创新发展研究院牵头成立建设的纳米抗体产业平台。其总部位于武汉东湖新技术开发区武创院本部大楼,在武汉生物城精准医疗产业基地拥有占地面积达1400㎡的自主实验室,并在武汉左岭与黄冈团风分别建立了符合实验动物标准的羊驼实验基地与转运基地,目前基地在饲养的羊驼共600余头,可为科研机构及抗体药物研发企业提供“零免疫背景”保障的羊驼免疫服务。
纳博生命专注于纳米抗体开发、改造与应用,致力于构建产、学、研一体化的实验公共服务平台。现拥有从抗原制备(多肽、蛋白及RNA),到抗体发现和抗体工程,再到生物学功能验证/筛选的全链路技术平台。其中RNA抗原包括针对羊驼进行RNA结构和序列优化的RNA;抗体发现与抗体工程服务采用噬菌体展示、RNA以及哺乳动物细胞展示在内的多种技术路线。通过多平台的交叉互补为药企及科研院所提供灵活的抗体发现及改造服务,助力药物试剂的研发。
除纳米抗体天然文库外,纳博生命科技还推出了现货免疫库,帮助客户快速筛选符合需求的抗体分子。
联系方式:400-822-9180 丨 联系邮箱:marketingdept@nanobodylife.com







