由法国细胞整合生物学研究所及居里研究所等科研单位发表于《Molecular Therapy:Oncology》的研究中表明,研究团队通过实验筛选出VSV-G骨架优化突变(H22N和S422I),成功解决氨基端融合纳米抗体导致的功能缺陷。研究人员将靶向HER2受体的纳米抗体与优化后VSV-G融合,并引入K47Q或R354Q突变消除LDL-R结合能力,最终构建的嵌合体可使伪型VSV(VSVΔG-GFP)和慢病毒特异性靶向感染HER2阳性细胞,为HER2阳性肿瘤的靶向溶瘤治疗与基因治疗提供了高效、安全的技术平台,也为其他靶点的靶向治疗研发奠定基础。
初始嵌合体构建与骨架优化突变
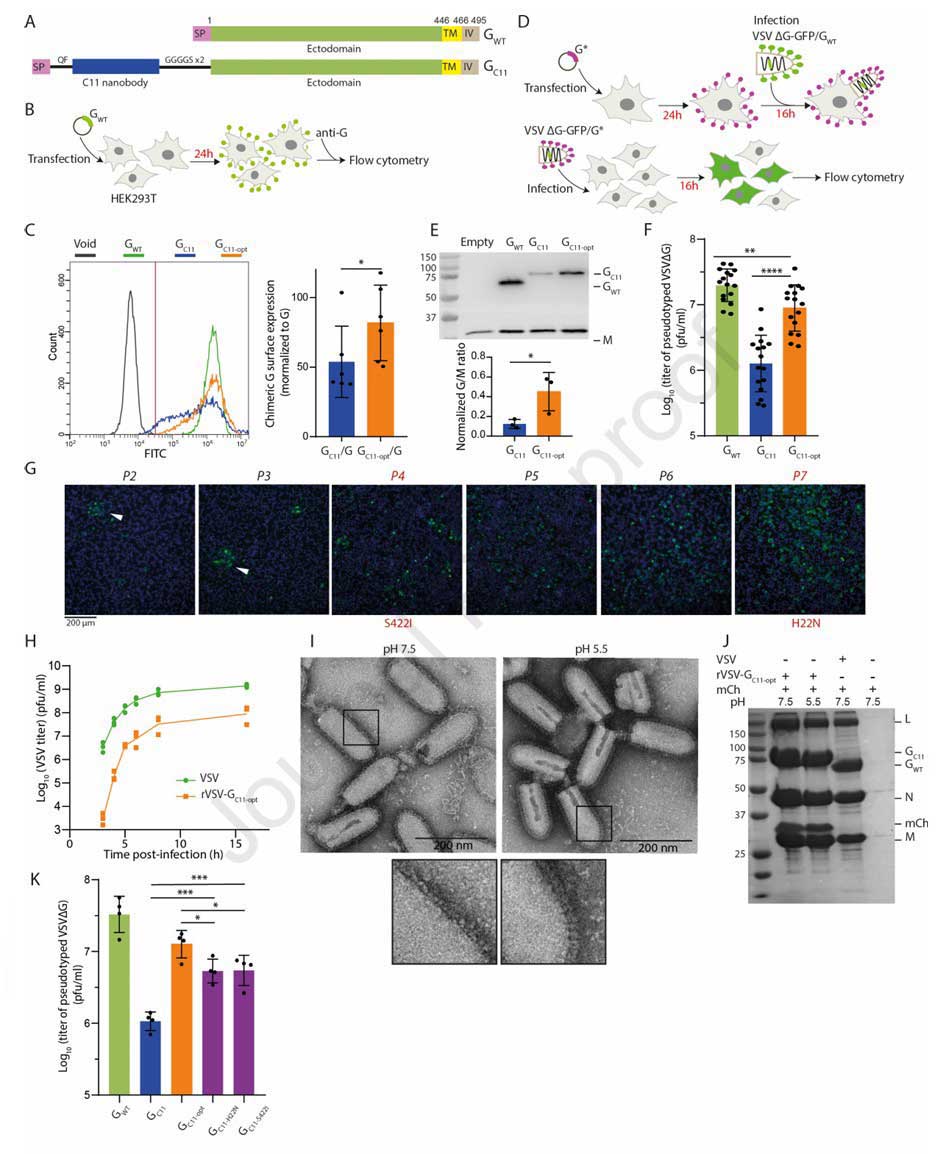
研究团队首先构建了靶mCherry的嵌合糖蛋白GC11,他们将C11纳米抗体通过QF二肽和GGGGS×2柔性连接肽,插入VSV-G信号肽与胞外域之间。通过转染HEK293T细胞检测发现,与野生型VSV-G(VSV-GWT)相比,GC11在细胞表面的表达量显著降低,仅为VSV-GWT的53±23%。
随后的伪型病毒实验进一步证实其功能缺陷:GC11整合到VSVΔG-GFP包膜的效率低于VSV-GWT,且伪型病毒的感染滴度比VSV-GWT低1.3 Log₁₀。这表明,纳米抗体直接融合于VSV-G氨基端会严重影响其正常功能。
为解决上述问题,研究团队开展实验进化:将GC11基因替换VSV基因组中的G基因,构建重组病毒rVSV-GC11,在BSR细胞中连续传代并监测病毒滴度与基因突变情况。传代结果显示,第4代病毒中出现了S422I突变,此时病毒滴度略有提升;第7代出现第二个突变H22N,与S422I形成组合,导致病毒滴度大幅提升,病毒滴度从初始的~10⁵ pfu/ml 飙升至~10⁷ pfu/ml;传至第10代,病毒基因组中仅保留H22N和S422I双突变,感染后16小时的终点滴度稳定在~10⁸ pfu/ml。这表明两个突变对恢复嵌合体功能具有协同增效作用,该双突变组合被命名为GC11-opt,同时也被确定为VSV-G骨架的关键优化突变。
图1:VSV-G骨架优化的核心实验与结果
优化突变功能验证与机制探究
为明确双突变的作用,研究团队从多维度开展验证。表面表达实验显示,GC11-opt在HEK293T细胞表面的表达量达VSV-GWT的81±24%,显著高于GC11;Western blot检测发现,GC11-opt整合到伪型VSV包膜的效率比GC11提升约2倍;感染实验中,由GC11-opt包裹的伪型化VSVΔG-GFP的滴度比GC11提升7倍,接近VSV-GWT水平。
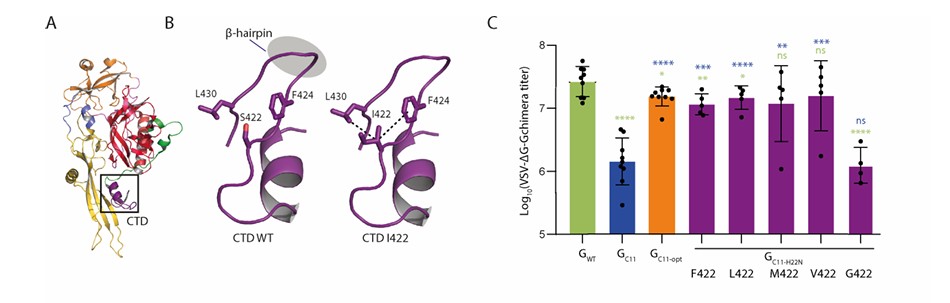
进一步对S422位点的探究发现:将S422I替换为其他疏水氨基酸时,伪型病毒滴度与GC11-opt无显著差异;若替换为非疏水的甘氨酸,滴度则回落至GC11水平。结合结构分析可知,S422I通过与邻近的F424、L430形成疏水堆积作用,稳定VSV-G的β-发夹结构,而H22N虽分子机制尚不明确,但可显著提升嵌合体的细胞表面表达,二者协同修复了纳米抗体融合导致的功能缺陷。
图2:VSV-G 422位氨基酸特性对纳米抗体融合兼容性的影响
优化骨架对不同纳米抗体的兼容性验证
为确认优化骨架的通用性,研究团队将11种不同纳米抗体融合于优化前后的VSV-G骨架,对比伪型VSVΔG-GFP的滴度。
结果显示,11种纳米抗体中,9种在优化骨架中的伪型病毒滴度显著提升,优化因子范围为6.5-29,几何均值达11。其中,C8纳米抗体的优化效果最显著,优化因子达29.5;H1-H6等抗HER2纳米抗体的优化因子也均在6.5以上,证明优化骨架对多数纳米抗体具有良好兼容性,尤其适用于抗HER2纳米抗体的融合。
靶向嵌合体构建与特异性验证
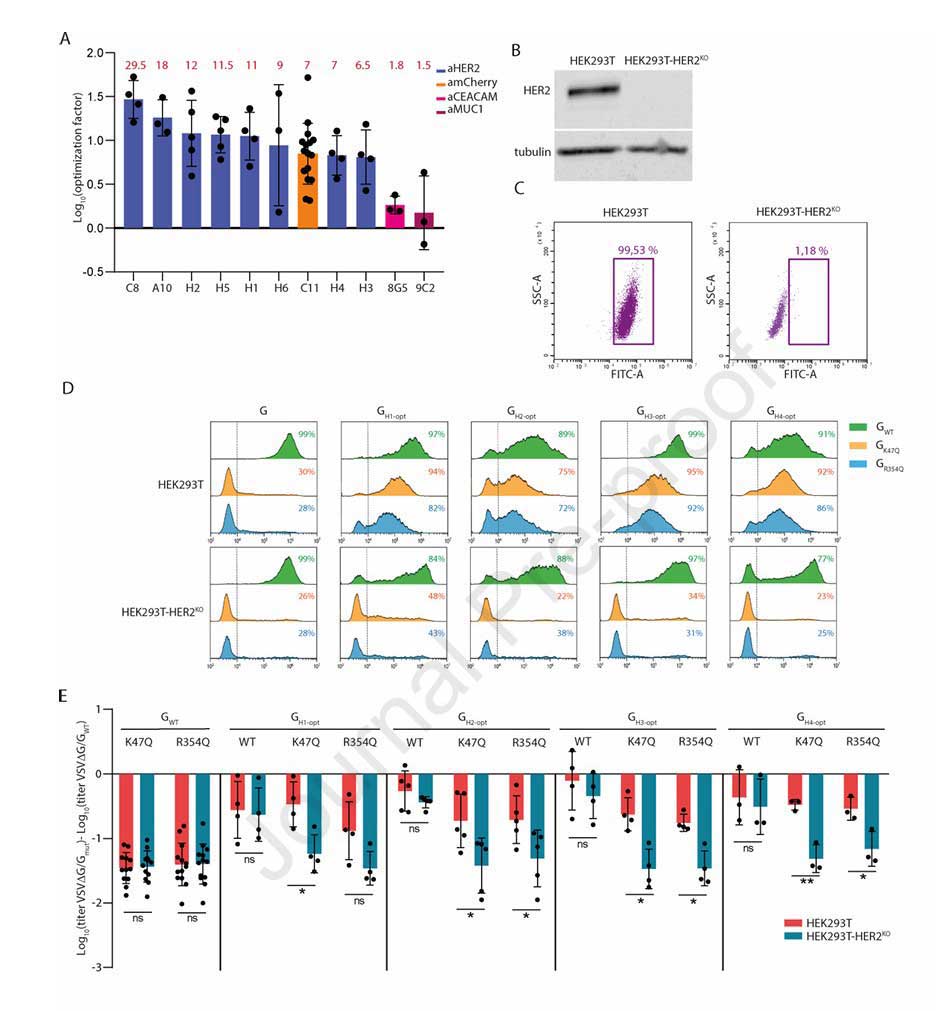
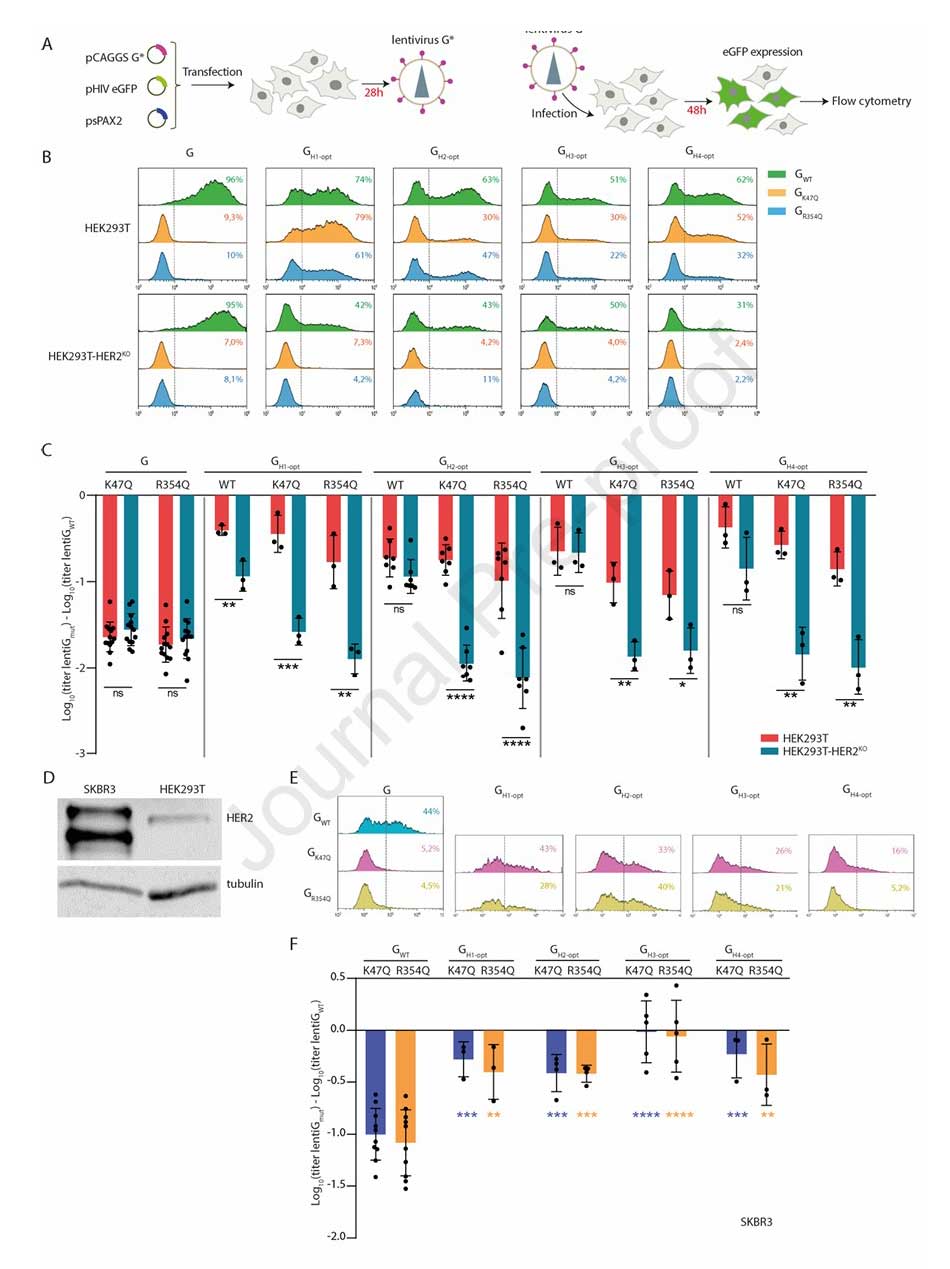
为实现精准靶HER2阳性细胞,研究团队在HER2优化嵌合体(如 H1-opt、H2-opt等)中引入K47Q或R354Q突变,消除其与LDL-R的结合能力。同时,构建HER2敲除细胞系(HEK293T-HER2KO),通过对比HEK293T(HER2阳性)与HEK293T-HER2KO(HER2阴性)的感染效率,验证靶向特异性。
图3:抗HER2纳米抗体嵌合体的功能优化与靶向性验证
实验结果显示:在HEK293T细胞中,含K47Q/R354Q的抗HER2嵌合体伪型VSV滴度与VSV-GWT无显著差异;而在HEK293T-HER2KO细胞中,其滴度显著降低,与仅含K47Q/R354Q的非靶向突变体(GK47Q、GR354Q)相当。在高表达HER2的SKBR3乳腺癌细胞中,含K47Q/R354Q的抗HER2嵌合体伪型慢病毒的感染效率相比GK47Q/GR354Q有数十倍至上百倍的显著提升。
图4:HER2靶向嵌合体伪型慢病毒的感染特异性验证
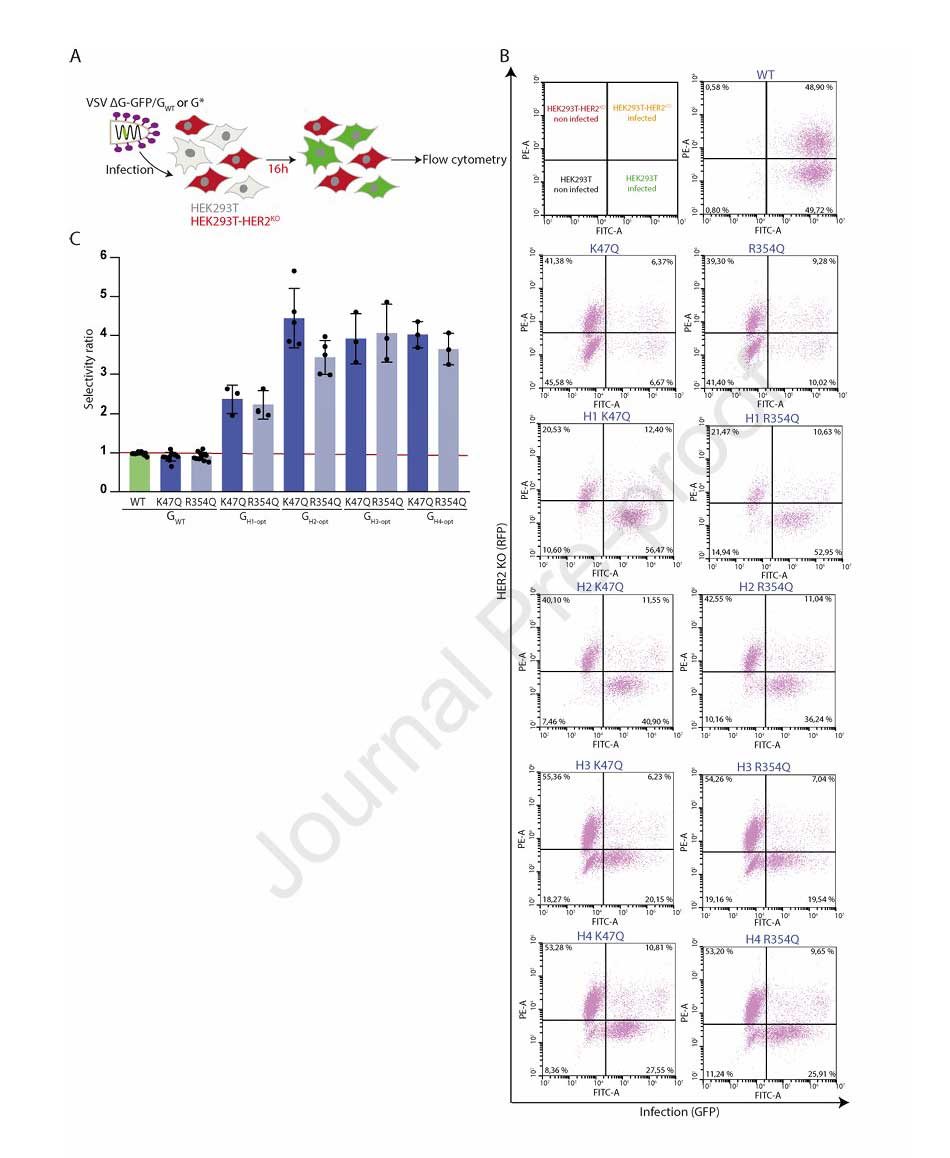
为进一步验证选择性,研究团队共培养HEK293T(HER2阳性)与HEK293T-HER2KO(RFP标记,HER2阴性)细胞,发现含K47Q/R354Q的抗HER2嵌合体伪型VSV对HER2阳性细胞的选择性指数为2.25-4,充分证明其可特异性识别并感染HER2阳性细胞。
图5:VSV嵌合体在混合细胞中的靶向选择性验证
该研究首次筛选出普适性很强的VSV-G优化骨架,解决了N端融合纳米抗体导致的功能缺陷问题,实现了VSV和慢病毒对HER2阳性肿瘤的精准靶向,降低脱靶毒性,推动体内精准治疗的应用研究。同时,该嵌合体可用于工程化细胞外囊泡,实现药物、基因等载物的靶向递送,拓展治疗场景。且该研究建立的“VSV-G优化骨架+纳米抗体”技术具有一定的通用性,这种策略为不同疾病的新型靶向药物研究提供了新的思路。

武汉纳博生命科技有限公司是由武汉产业创新发展研究院牵头成立建设的纳米抗体产业平台。其总部位于武汉东湖新技术开发区武创院本部大楼,在武汉生物城精准医疗产业基地拥有占地面积达1400㎡的自主实验室,并在武汉左岭与黄冈团风分别建立了符合实验动物标准的羊驼实验基地与转运基地,目前基地在饲养的羊驼共600余头,可为科研机构及抗体药物研发企业提供“零免疫背景”保障的羊驼免疫服务。
纳博生命专注于纳米抗体开发、改造与应用,致力于构建产、学、研一体化的实验公共服务平台。现拥有从抗原制备(多肽、蛋白及RNA),到抗体发现和抗体工程,再到生物学功能验证/筛选的全链路技术平台。其中RNA抗原包括针对羊驼进行RNA结构和序列优化的RNA;抗体发现与抗体工程服务采用噬菌体展示、RNA以及哺乳动物细胞展示在内的多种技术路线。通过多平台的交叉互补为药企及科研院所提供灵活的抗体发现及改造服务,助力药物试剂的研发。
联系方式:400-822-9180 丨 联系邮箱:marketingdept@nanobodylife.com
参考文献:Duquénois, Isoline et al. “Optimization of the VSV-G backbone for amino terminal fusion with nanobodies allowing its specific retargeting to HER2 receptors.” Molecular therapy. Oncology vol. 33,4 201065. 25 Sep. 2025, doi:10.1016/j.omton.2025.201065