CD5靶点在免疫B细胞中的作用机制[1]
CD5抗体的临床应用领域
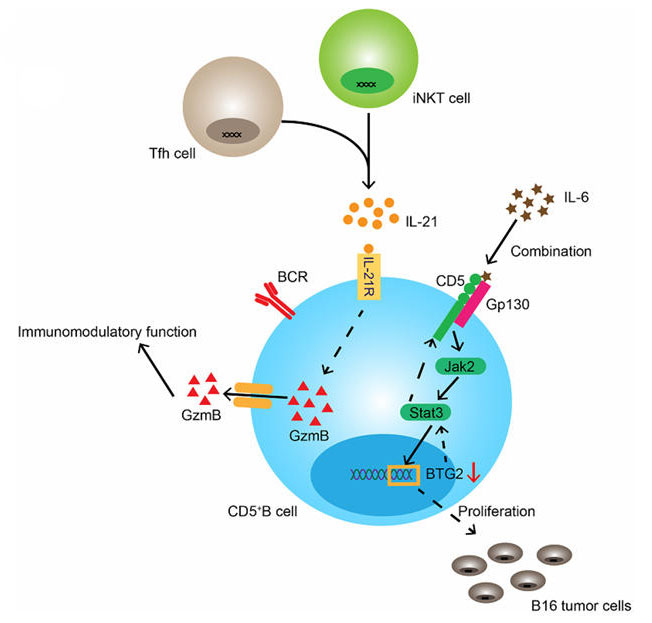
CD5本质上是一个关键的抑制性共受体,具有免疫反应调节的核心功能。当T细胞被抗原激活时,CD5传递的抑制信号能够提高其激活阈值,防止免疫系统因微弱刺激或自身抗原而过激反应,然而这个调控机制在疾病发展过程中展现了其两面性:例如在急性T淋巴细胞白血病(T-ALL)、T细胞淋巴瘤的肿瘤微环境中,肿瘤细胞常常高特异性表达CD5,且可能利用其抑制性信号促进自身存活;而在如系统性红斑狼疮(SLE)、类风湿关节炎(RA)等自身免疫性疾病当中,CD5⁺B 细胞的功能则具有双重性,既可能产生自身抗体引发病理损伤,也可通过分泌抗炎因子发挥保护作用。基于这一独特的机制,使得CD5靶点及其抗体药物在临床应用领域主要聚焦于血液肿瘤治疗及自身免疫性疾病两大方向。
CD5抗体药物研发进展及成药案例
目前,全球范围内的CD5抗体药物研发以细胞免疫疗法为主流,且多款药物已进入临床阶段并展现出显著治疗潜力。
- CAR-T细胞免疫疗法:
- MB-105:马奇生物研发的MB-105应属目前最具代表性的细胞免疫疗法药物,该药物已获得美国FDA授予的孤儿药资格(ODD)和再生医学先进疗法(RMAT)认定,用于治疗复发/难治性CD5阳性T细胞淋巴瘤。其核心机制是通过基因工程技术给患者自体T细胞表达特异性识别CD5的嵌合抗原受体(CAR)。输注后,CAR-T细胞可精准结合CD5阳性肿瘤细胞,激活T细胞的杀伤信号通路,释放穿孔素、颗粒酶等细胞毒性物质,特异性裂解肿瘤细胞。同时,该疗法通过优化CAR结构降低脱靶风险,临床中展现出良好的肿瘤杀伤活性与可控的安全性;
- CT125:由驯鹿生物自主研发的全人源双表位靶向CD5的CAR-T细胞治疗产品CT125的核心机制是采用 CRISPR/Cas9技术敲除T细胞自身的CD5基因,从根源上避免CAR-T细胞因表达CD5而引发的自激活与自相残杀问题。CT125的CAR结构可增强与肿瘤细胞CD5抗原的结合亲和力,提升T细胞活化效率与杀瘤特异性,实现对CD5阳性血液肿瘤细胞的精准高效清除;
- VIPER-101:该药物是由Vittoria Biotherapeutics公司基于自身Senza5TM平台开发的一款靶向CD5的自体CAR-T细胞免疫治疗产品,通过基因编辑敲除T细胞表面CD5基因,避免CAR-T细胞相互杀伤,保障体内存活与增殖能力。同时,其CAR结构可特异性结合肿瘤细胞CD5,激活T细胞免疫应答,释放细胞毒性因子清除肿瘤。目前,该药物已获得美国FDA的临床批准,用于治疗复发或难治性T细胞淋巴瘤;
- 双靶点/增强型细胞免疫疗法:
- AB-205:AB-205是由Artiva与GC Cell共同合作开发的一款靶向CD5的CAR-NK细胞免疫治疗产品,该产品包含具有CD5抗原识别域的CAR,并表达可溶性IL-15,在输注后可精准识别CD5+T细胞,对白血病细胞系CCRF-CEM和RPMI-8402具有特异性细胞毒性,同时利用了NK细胞天然不表达或低表达CD5的特性降低了正常细胞自相残杀的风险;
- ICG124:该药物是由Icell Gene研发的一款IL-15表达型CD5靶向CAR-T细胞治疗产品。该产品在传统的CAR结构上融入了IL-15自表达结构域。该复合型CAR结构在与肿瘤细胞 CD5抗原结合时可激活T细胞肿瘤杀伤活性。同时,复合型CAR结构分泌的IL-15可增强T细胞增殖、存活能力与细胞毒性,改善肿瘤微环境免疫抑制状态,实现靶向杀伤和免疫增强的双重作用;
- BAH246(EB-BH2026):这是由Essen生物开发的一款CD5/CD7双靶点CAR-T细胞治疗产品。该产品的CAR结构可同时表达CD5与CD7特异性结合域,双重识别急性淋巴细胞白血病细胞表面的CD5和CD7抗原,提升肿瘤识别特异性,减少抗原逃逸与耐药;激活 T 细胞杀伤信号,增强活化程度与持续杀瘤能力;
纳米抗体在CD5抗体药物开发中的优势
纳米抗体凭借自身卓越的穿透性、高稳定性与易于改造的特性已在多种靶点分子的成药领域的研究中展示出惊人的表现。如自身小分子体积的优势可使其轻易渗透至肿瘤微环境核心区域,实现高浓度靶向给药的作用。其次,纳米抗体易于工程化改造的特性则可作为靶向递送载体来增强免疫激活功能,延长体内半衰期,同时还可规避脱靶毒性与细胞自相残杀现象。
如:由广东省人民医院及南方医科大学等多所机构联合开展的研究中设计出一款名为BiCD30/5-GF的药物分子,该分子由特异性靶向CD5和CD30的纳米抗体串联组成,通过Gv/Sd系统偶联人铁蛋白(h-HFn)和颗粒酶B(GrB),借助CD5/CD30双靶点识别T细胞淋巴瘤细胞,同时利用h-HFn与CD71的结合增强细胞内化,可精准识别肿瘤细胞并高效介导胞内GrB递送,激活caspase-3/BID通路诱导凋亡[2]。
而由四川大学华西医院主导研发的1H6-15-NKCE以抗CD5单链抗体为靶向模块,搭配抗CD16a纳米抗体,同时融合IL-15Rα/IL-15复合物,形成三特异性结构。通过CD5靶向结合肿瘤细胞、CD16a衔接NK细胞(增强结合作用)、IL-15刺激JAK/STAT信号通路增强NK细胞增殖与活性的三重作用实现肿瘤细胞特异性裂解[3]。
以上两项研究均展现出了纳米抗体高特异性、低脱靶风险、精准识别抗原表位、穿透肿瘤微环境能力强、递送效率高的特性。同时,纳米抗体凭借结构灵活,易于多模块改造的特性又可适配于不同治疗场景,在人源化改造后显示出半衰期长、免疫原性低、安全性更优的独特优势。
纳博生命拥有的pDual噬菌体展示技术,能够在传统噬菌体展示的高效开发的基础上,无缝连接哺乳动物细胞高效生产,大大提高筛除问题分子的效率;而NabLib®哺乳动物细胞展示技术,不仅可以提升筛选分子的可开发性,还可以灵活地选择抗体的筛选构型,为下游抗体分子的应用和检测提供更好的保障。
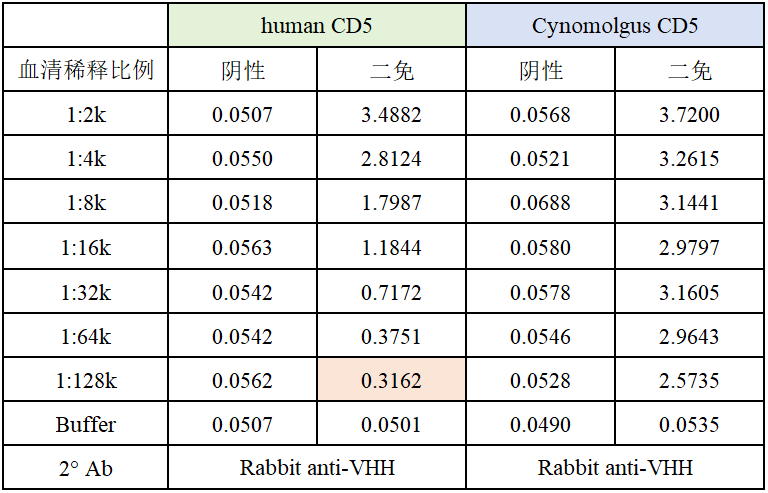
同时,纳博生命推出CD5现货免疫文库。在完成羊驼免疫后,我们采集羊驼全血,分离PBMC以细胞库的形式冻存,客户可跳过冗长的免疫周期,直接进入筛选流程,大大节约抗体分子开发时间。通过定制化的筛选服务,获取最符合应用需求的多个抗体分子。