一、G 蛋白偶联受体存在多种聚合形式
G蛋白偶联受体(G protein coupled receptor,GPCR),是细胞表面一类非常重要的受体蛋白,人类基因组中,GPCR编码基因所占比例超过2%,包含超过800个成员,是最大的一类细胞膜蛋白[1]。GPCR参与调节体内多种细胞反应,与GPCR相关的信号通路涉及各种疾病的病理生理学,从代谢、免疫和神经退行性疾病到癌症和传染病,许多GPCR扮演重要的角色,是重要的药物开发靶点[2]。
GPCR主要分为A、B、C三个大家族,传统的观念认为,GPCR主要以单体的形式发挥作用,现有的结构数据也显示,单体的GPCR可以同时结合激动剂和G蛋白。利用荧光共振能量转移等技术,发现很多A/B家族的GPCR可能存在同源二聚化的现象,如β2AR、AT1R、5HT2C、D2R等受体[3, 4]。
C家族GPCR主要包括mGlu受体,mGlu受体有8个成员,是精神系统疾病的重要药物靶点[5]。mGlu被认为是典型的同源二聚体,目前没有证据显示mGlu受体可以在单体的情况下发挥作用。而在过表达系统中,mGlu不同亚基之间还可以形成16种不同的mGlu异源二聚体[6](图1),并具有和同源二聚体不一致的特定药理学特性[7](图2)。由于缺乏有效的工具,包括但不限于没有特异性、高亲和力和识别受体空间构象的抗体,mGlu异源二聚体在大脑中的存在还一直缺乏直接证据。
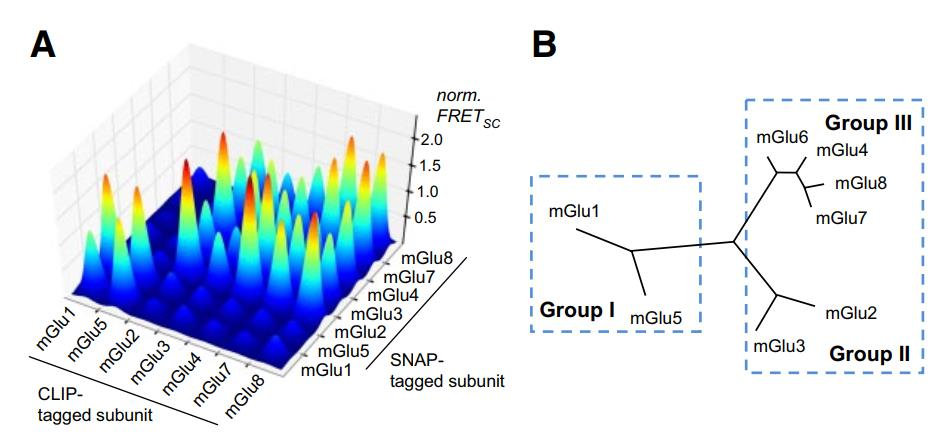
图1 过表达体系中mGlu受体存在同源和异源二聚的情况
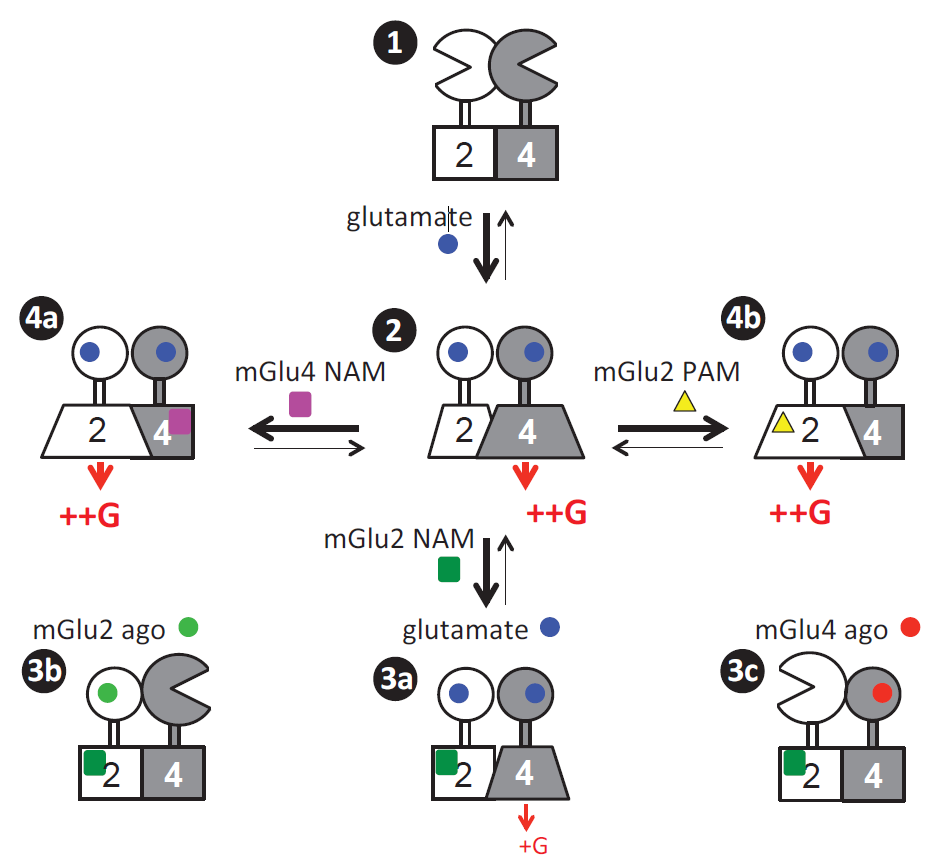
图2 mGlu2和mGlu4异源二聚体存在多种激活下游信号的模式
二、纳米抗体为 GPCR 的研究提供了强有力的工具
1993年,比利时科学家在自然杂志中首次报道羊驼外周血液中存在一种天然缺失轻链的抗体,该种抗体只包含一个重链可变区(VHH)和两个常规的CH2与CH3区,却具有非常好的稳定性。单独克隆并表达出来的VHH结构具有与原重链抗体相当的结构稳定性以及与抗原的结合活性,是目前已知的可结合目标抗原的最小单位,其分子量只有约15kD,也因此被称作纳米抗体[8, 9]。
纳米抗体由于具有尺寸小,结构简单,肿瘤组织穿透能力更强和容易穿过血脑屏障,亲和力高,免疫原性低,亲水性好、稳定性高和易改造等特点,已广泛用于开发针对GPCR家族成员的药物抗体。当前已有很多报道显示,靶向多种GPCR成功开发到纳米抗体,除了基于纳米抗体开发了一系列检测GPCR各项指标的科研工具之外,也检测到明显对GPCR功能调控作用的纳米抗体,纳米抗体为GPCR的研究中提供了强有力的检测工具[8]。
三、纳米抗体可以高亲和力、高特异性识别和区分mGlu受体不同亚型
mGlu受体的8个成员序列同源性非常高,尤其是亚族内,小分子配体、抗体等很难有效区分,这在对分析不同成员的功能的工作中造成很大的困难。纳米抗体由于对靶点空间构象的特异性识别,可以非常准确区分和识别不同亚型。例如,在2017年的NC报道中,研究者开发的纳米抗体DN1等在HTRF的检测方法处理下,可以非常精准区分mGlu2和其他家族的成员,这是除了从基因序列上可以区分mGlu2和mGlu3这两个亚型之外,目前唯一的方法[10]。
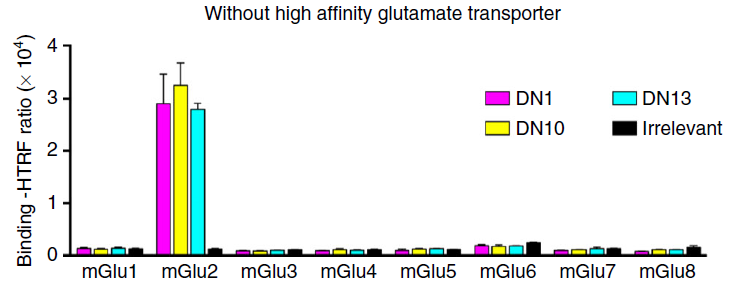
纳米抗体由于其高亲和力和高特异性,在GPCR的识别和检测等领域将发挥巨大的作用
四、基于纳米抗体开发生物传感器,检测mGlu受体内源性同源和异源二聚体的存在
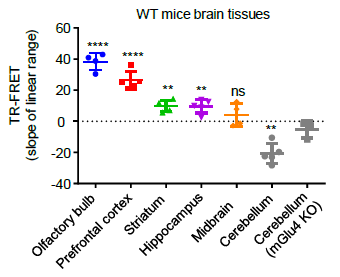
研究者可以在脑样本中检测mGlu2同源二聚体和mGlu2-4异源二聚体的激活,并对脑样本中内源表达的受体的活性进行完整的药理学分析。采用这种新方法,该研究发现在脑组织样本中mGlu4以mGlu2-4异源二聚体的形式在大多数脑区域表达,而在小脑区域mGlu4只以同源二聚体存在[11]。该发现提示了以mGlu2-4异源二聚体作为药物靶点的药物开发新策略,为以前开发出来的已有的靶向mGlu2和mGlu4的药物“老药新用”提供了理论基础。此外,该方法实现了活体组织中的内源性膜受体复合物活性的快速和高通量的药理学检测,解决了长久以来检测人和动物组织中内源表达的膜蛋白复合物表达分布以及活性的难题。
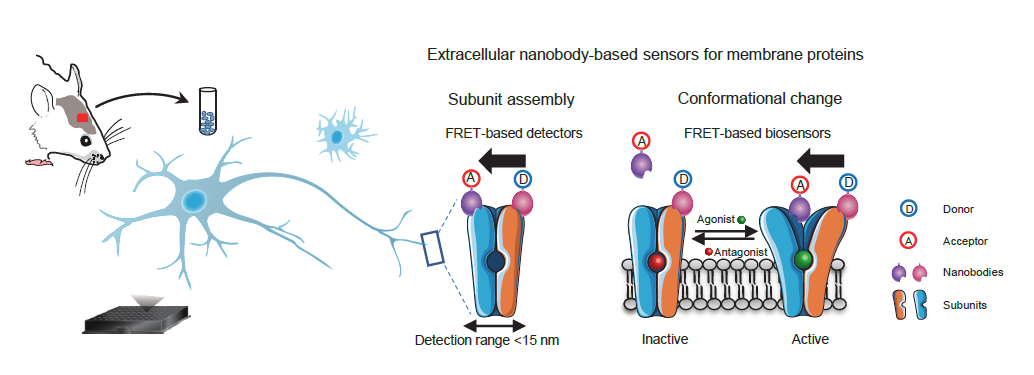

mGlu2 homodimer
mGlu2-4 heterdimer
纳米抗体在 GPCR 的研究中发挥着重要的作用,在未来,纳米抗体将会辅助科学工作者进一步了解 GPCR 更多的奥秘。武汉纳博生命科技有限公司以自主开发设计的高通量抗体筛选与检测平台为基础,拥有多年的GPCR抗体筛选经验,致力于提供更专业的靶向GPCR纳米抗体筛选等CRO服务。
参考文献
[1] Dorsam R T, Gutkind J S. G-protein-coupled receptors and cancer[J]. Nat Rev Cancer, 2007,7(2):79-94.
[2] Hauser A S, Chavali S, Masuho I, et al. Pharmacogenomics of GPCR Drug Targets[J]. Cell, 2018,172(1-2):41-54.
[3] Cottet M, Albizu L, Comps-Agrar L, et al. Time resolved FRET strategy with fluorescent ligands to analyze receptor interactions in native tissues: application to GPCR oligomerization[J]. Methods in molecular biology (Clifton, N.J.), 2011,746:373.
[4] Hern J A, Baig A H, Mashanov G I, et al. Formation and dissociation of M1 muscarinic receptor dimers seen by total internal reflection fluorescence imaging of single molecules[J]. Proc Natl Acad Sci U S A, 2010,107(6):2693-2698.
[5] Pin J P, Bettler B. Organization and functions of mGlu and GABAB receptor complexes[J]. Nature, 2016,540(7631):60-68.
[6] Doumazane E, Scholler P, Zwier J M, et al. A new approach to analyze cell surface protein complexes reveals specific heterodimeric metabotropic glutamate receptors[J]. The FASEB Journal, 2011,25(1):66-77.
[7] Liu J, Zhang Z, Moreno-Delgado D, et al. Allosteric control of an asymmetric transduction in a G protein-coupled receptor heterodimer[J]. Elife, 2017,6.
[8] Manglik A, Kobilka B K, Steyaert J. Nanobodies to Study G Protein-Coupled Receptor Structure and Function[J]. Annu Rev Pharmacol Toxicol, 2017,57:19-37.
[9] Muyldermans S. Nanobodies: natural single-domain antibodies[J]. Annual review of biochemistry, 2013,82(1):775-797.
[10] Scholler P, Nevoltris D, de Bundel D, et al. Allosteric nanobodies uncover a role of hippocampal mGlu2 receptor homodimers in contextual fear consolidation[J]. Nat Commun, 2017,8(1):1967.
[11] Meng J, Xu C, Lafon P A, et al. Nanobody-based sensors reveal a high proportion of mGlu heterodimers in the brain[J]. Nat Chem Biol, 2022.







