在生物医学领域中,研究人员经常会利用固定策略将抗体或目标蛋白固定在某一固相载体表面用于免疫检测分析及筛选。但传统的固定方法通常如:共价键结合法、吸附固定法等。但绝大多数固定化方法都存在着固定化方向随机、固定化量低、酶容易失活等问题[1,2]。这些问题使得科研成本和工作量上升,对于一些表达能力低下的目标分子或物质来说,科研难度更大。

例如,研究人员在传统方式对酶进行非定向固定及分离回收时发现,酶会从游离状态变为固定状态,且目前常用固定化的载体一般为疏水性物质,会导致酶蛋白构象发生折叠[3]。这种情况下通常会使酶的功能结构发生但一定的变化,导致酶的活性受损而降低了酶的活收率与使用时间[4]。
而定向固定法通常将小分子蛋白与载体蛋白或生物素进行偶联,将目标固定在合适的固相载体表面上。这种方法能够保持酶的天然结构等优点。然而,酶与载体之间的结合力较弱,容易遭受缓冲液类型、pH、离子强度等因素的影响,难以应付严苛的洗涤与洗脱条件,从而导致酶脱落的现象[5]。因此,此类蛋白的定向固定仍需要更加良好的固定策略。

近日,由中国科学院青岛生物能源与过程研究所蛋白质材料研究组开发出的聚苯乙烯表面纳米抗体定向固定技术的研究成果已发表在《分析化学》(Analytical Chemistry)上。
该研究利用全合成纳米抗体文库筛选获得纳米抗体B2,该纳米抗体对聚苯乙烯表现出高亲和力。ELISA 饱和结合分析为 0.7 nM,等温滴定量热法为 15.6 nM,且在结合过程几乎不受疏水作用和静电作用的影响。通过对分子模型的研究,揭示了纳米抗体B2的CDR2环内Trp51残基与聚苯乙烯在2.74Å的距离处形成了关键的芳香氢键。为了探索B2在纳米抗体定向固定化方面的潜力,研究将B2与在聚苯乙烯表面无法被动吸附的癌胚胎抗原纳米抗体11C12进行融合表达,构建了双特异性纳米抗体。这一融合蛋白在5分钟内便可直接从发酵液中实现在聚苯乙烯表面的有效定向固定化,并在化学发光酶联免疫分析中表现出线性关系 [6]。
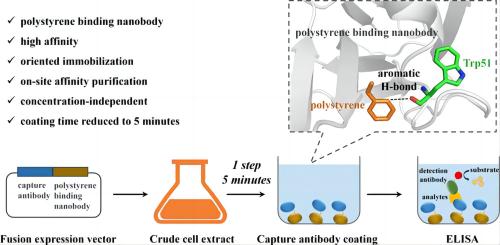
图:纳米抗体B2的CDR2环内Trp51残基与聚苯乙烯结合原理 来源:ACS Publications
纳米抗体作为新一代抗体,其高亲和力与结合能力等特性使其作为科研工具,在肿瘤标志物检测、影像学诊断及目标分子标记等领域独树一帜。此项基于纳米抗体的定向固定技术研发思路向科研人员提供了一种新颖且可靠的定向固定技术的研发策略。
它在保持蛋白活性和结构的完整性的同时实现了目标蛋白质的定向固定的稳定性,并可适用于表达水平极低的目标蛋白。极大程度缩短了目标蛋白筛选检测等科研的等待时间,提升活收率与应用蛋白范围,实现科研降本增效。
纳博生命专注纳米抗体的改造与应用,致力于构建产、学、研一体化的实验公共服务平台,希望能为科研机构、医药机构、工业企业和创新团队等广大客户提供更专业、性价比更高的实验服务。