HSV要成功感染宿主细胞,必须完成“附着-融合”两步关键动作,其中gB蛋白是执行膜融合步骤的核心蛋白。它需要从“融合前构象”转变为“融合后构象”才能完成感染。然而,由于融合前gB蛋白是一种“metastable(亚稳态)”结构,脱离病毒膜后极易自发转变为融合后构象,因此,科学家长期以来无法解析其完整结构,也难以开发出能精准锁定这一构象的靶向分子。
今年9月3日,由德国汉堡结构系统生物学中心(CSSB)、莱布尼茨病毒学研究所等机构在《Nature》期刊上联合发表了一篇标题为“A nanobody specific to prefusion glycoprotein B neutralizes HSV-1 and HSV-2”的研究文章。文章表明该研究团队通过创新的“gB囊泡免疫+噬菌体展示”技术,从羊驼体内筛选出一款可特异性结合融合前gB蛋白的纳米抗体Nb1_gbHSV。该纳米抗体不仅能以1.2 nM的IC₅₀高效中和HSV-1,还可跨血清型结合HSV-2 gB。借助突变稳定与冷冻电镜技术,团队首次解析出HSV-1 gB全长融合前结构及HSV-2 gB融合前/后结构,揭示Nb1_gbHSV通过结合跨DI/DIII/DIV结构域的构象表位,锁定gB融合前状态以阻断膜融合,为HSV治疗与疫苗设计提供了“结构-功能”双重突破。
纳米抗体制备:模拟病毒天然状态突破筛选瓶颈
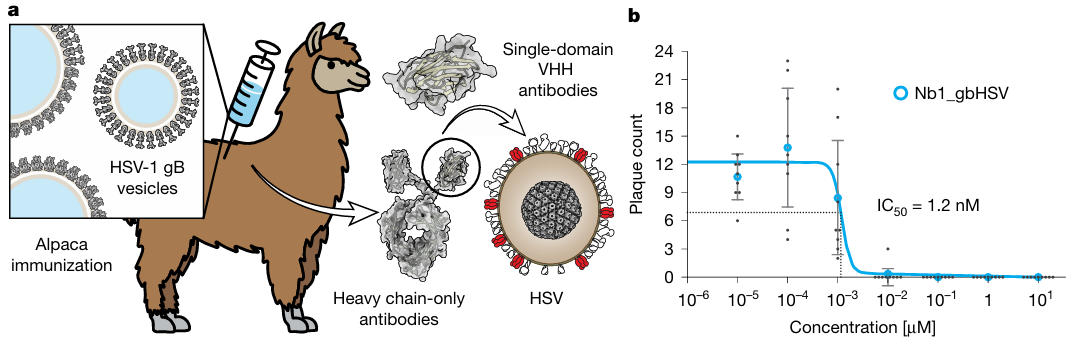
传统抗体制备常因纯化gB构象改变失败,研究人员创新性地采用gB囊泡免疫策略,将HSV-1 gB基因转染至BHK-21细胞,并收集细胞分泌的胞外囊泡。这些囊泡表面同时存在gB的融合前与融合后构象,完美模拟了病毒表面蛋白的天然状态。研究人员在将这类囊泡作为抗原免疫羊驼后,构建了噬菌体展示文库,再以gB囊泡为“诱饵”筛选阳性克隆。
经过两轮筛选与测序验证,17个候选纳米抗体进入活性测试阶段。在HSV-1斑块减少实验中,两个纳米抗体表现出抑制活性,但仅Nb1_gbHSV在低浓度下依然有效,当浓度低至1.2 nM时,即可抑制50%的病毒斑块形成(IC₅₀=1.2 nM),而其他16个抗体要么无活性,要么需极高浓度才起效。这一步不仅筛选出目标纳米抗体,更证明了“囊泡免疫”策略可引导免疫系统识别天然状态下的融合前构象表位。
图1:纳米抗体制备与活性验证
HSV gB蛋白结构稳定与结构解析
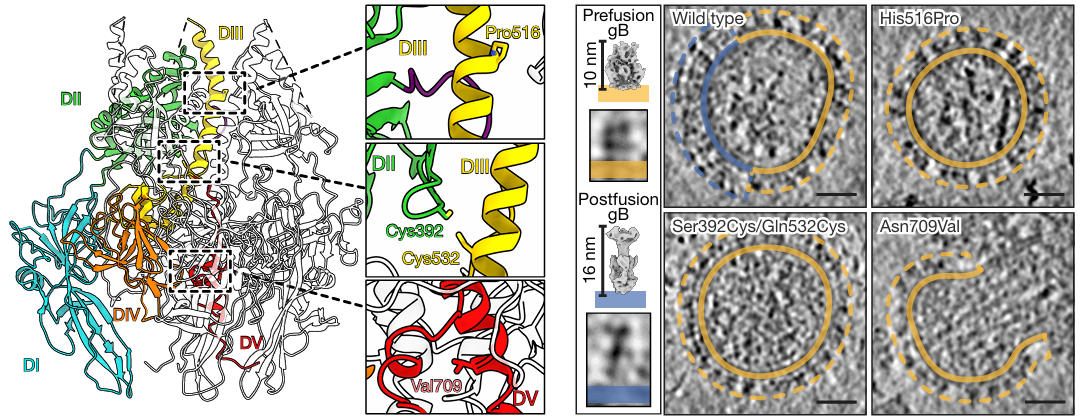
为了解析融合前gB的结构,研究人员首先需解决其亚稳态问题,基于前期HSV-1 gB的低分辨率模型,他们设计了三类稳定突变:一是通过双半胱氨酸突变(如 S392C/Q532C)在DI与DIII间形成二硫键,阻止结构域分离;二是将Domain V(DV)区域的第709位的天冬酰胺(N709)突变为缬氨酸(V),增强螺旋疏水性以稳定三聚体核心;三是保留此前发现的H516P突变,这种突变破坏了DIII中央螺旋的伸展能力。
通过冷冻电镜断层扫描观察,单一突变虽能提升融合前构象比例,但仍存在局部构象不稳定。最终,研究人员将上述多种稳定突变(包括S392C/Q532C二硫键、N709V和H516P)组合到一个构建体中,成功使gB囊泡表面的蛋白100%保持融合前构象。结果表明,仅当四种突变组合时,gB囊泡表面的蛋白才能完全保持融合前构象,且这些突变牢牢锁住了gB的关键结构域,为后续高分辨率结构解析奠定了基础,也为其他亚稳态病毒蛋白的稳定提供了可复用策略。
图2:稳定HSV gB融合前构象
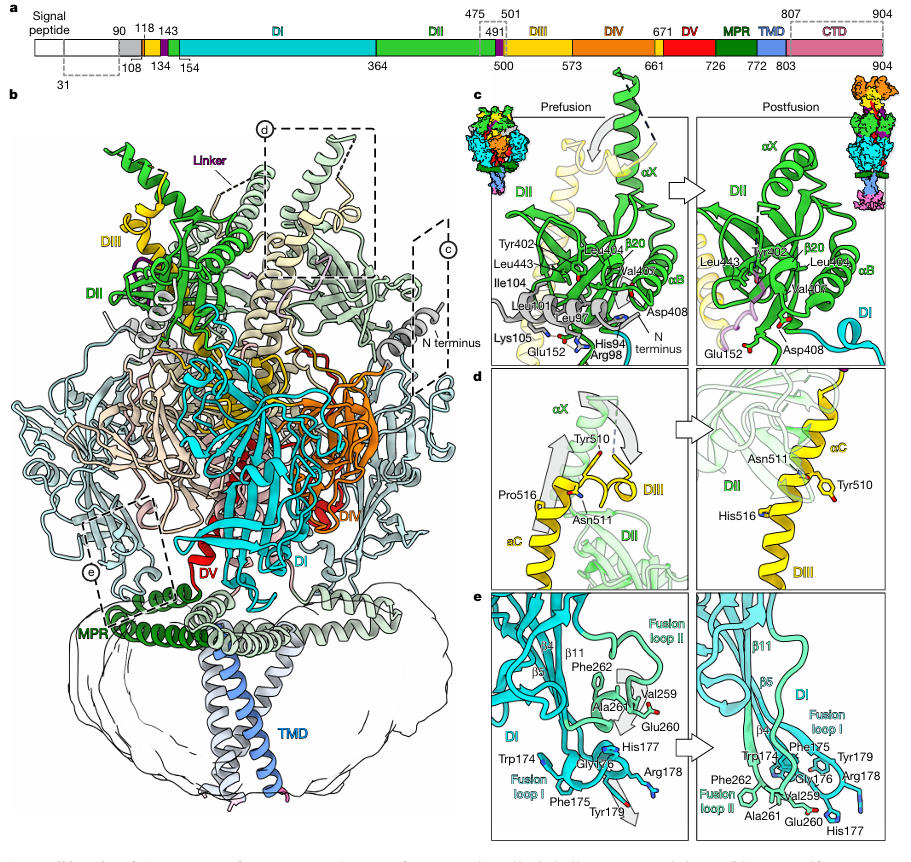
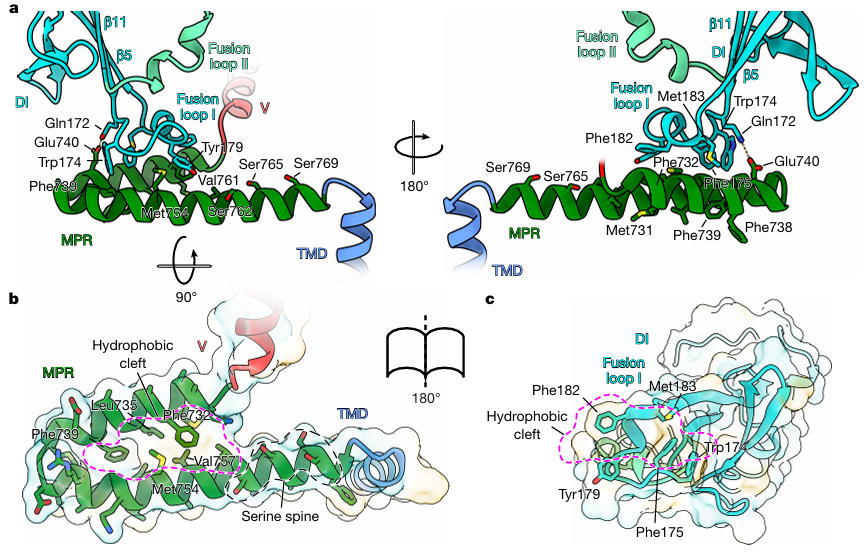
研究团队将稳定后的HSV-1 gB重组到肽圆盘中,然后通过单颗粒冷冻电镜解析出分辨率2.74 Å的融合前结构。该结构首次揭示了多个此前未被发现的关键特征:N端90-106残基形成α螺旋,嵌入DI与DII之间的凹槽,通过疏水作用(L97、I104)与盐桥(R98-E152)稳定构象;融合环I(174-179残基)并非传统认为的线性结构,而是卷曲成2圈3₁₀螺旋,恰好嵌入MPR(膜近端)区域的疏水凹槽中。
图3:HSV-1 gB融合前全长结构
图4:MPR与融合环的相互作用
更关键的是,当团队将Nb1_gbHSV与稳定后的gB共孵育后,解析出3Å分辨率的复合物结构。结果显示,Nb1_gbHSV的结合表位极具特殊性,它同时跨越DI、DIII与DIV三个结构域,这些区域在融合前构象中因结构紧凑而邻近,但在融合后构象中会因gB重排而分散至不同位置。通过微尺度热泳动测定,Nb1_gbHSV与融合前 gB的结合亲和力高达14 pM,而对融合后gB无任何结合能力,这也解释了其构象特异性中和机制。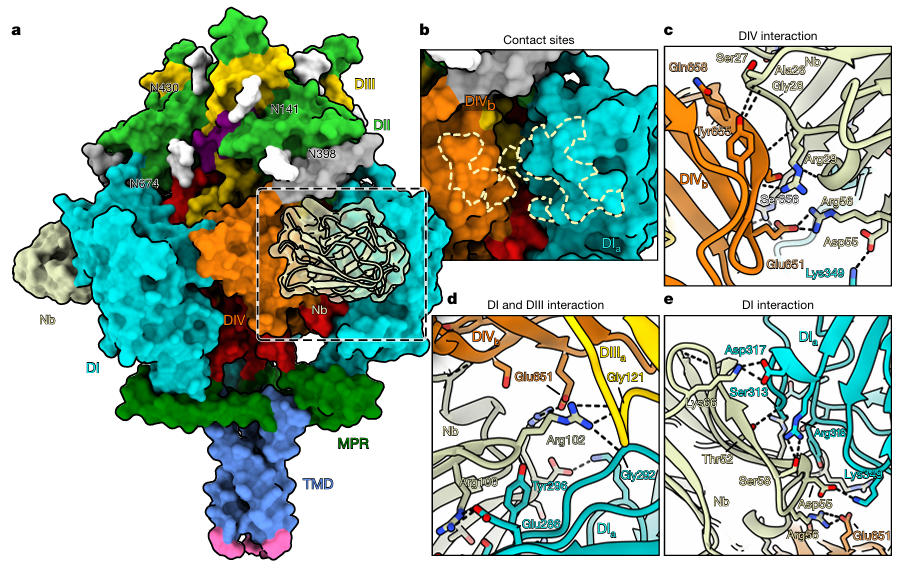
图5:Nb1_gbHSV与gB的结合模式
跨血清型验证:从HSV-1到HSV-2的“广谱防护”
考虑到HSV-2是生殖器疱疹的主要病原体,研究团队进一步验证 Nb1_gbHSV对HSV-2的作用。在细胞共定位实验中,研究人员用Alexa 647标记的Nb1_gbHSV可与带sfEGFP标签的HSV-2 gB在BHK-21细胞膜上共定位,而对VZV(水痘带状疱疹病毒)、HCMV(人巨细胞病毒)的gB无结合能力,证明其跨血清型特异性。
更重要的是,团队成功解析出HSV-2 gB融合前与融合后的结构。对比发现,HSV-2 gB的融合前构象与HSV-1高度相似,尤其是Nb1_gbHSV结合的表位残基完全保守,这为其跨血清型中和能力提供了结构依据。在冷冻电镜图谱中,仅在HSV-2 gB融合前构象上观察到Nb1_gbHSV的密度,进一步证实它能锁定HSV-2 gB的融合前状态。
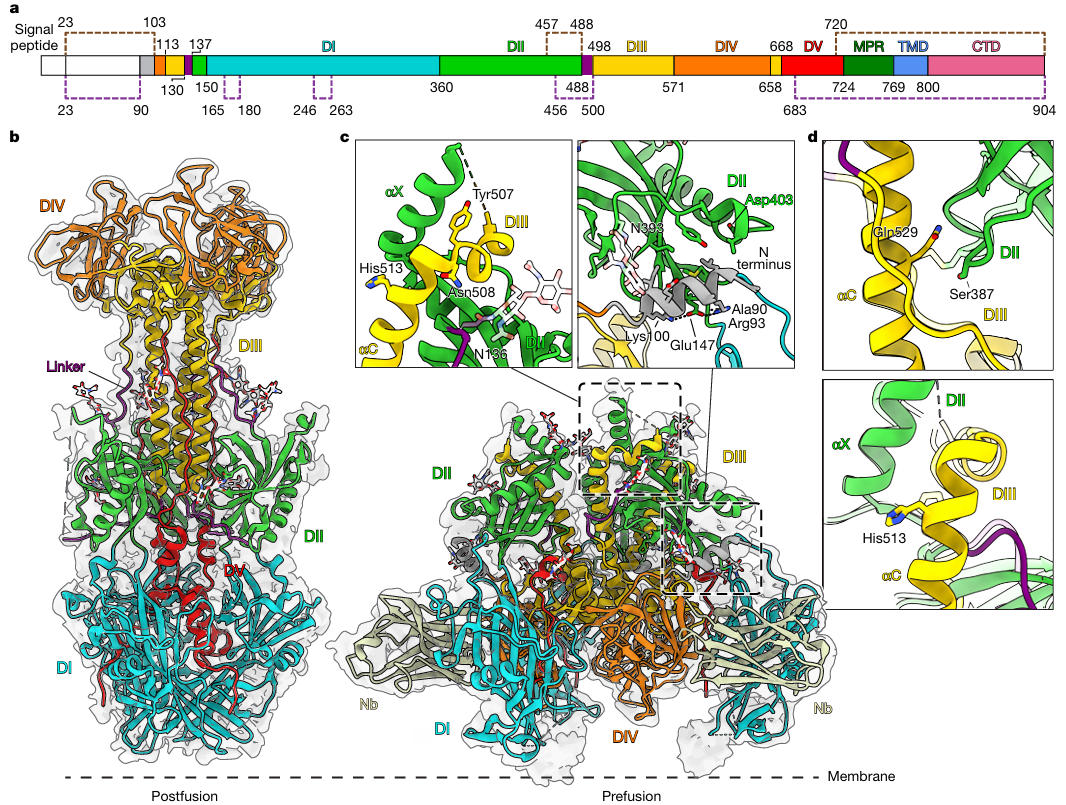
图6:HSV-2 gB融合前结构与Nb1_gbHSV结合
过去,由于HSV病毒的藏匿性与耐药性使得传统抗体在该领域难以获得重要性突破。无独有偶,纳米抗体技术在HSV治疗领域的潜力近期得到了多方印证。今年5月,由中国科学技术大学研究团队发表于《Nature》的研究表明,该团队同样以纳米抗体作为核心研发出一种双特异性纳米抗体Nb14-32-Fc,这种纳米抗体则以HSV的gD蛋白为核心靶点,采用“双表位协同+Fc段功能增强”的创新设计,将纳米抗体靶向gD蛋白的两个不同非重叠的表位,二者协同作用使双特异性抗体对HSV-2 gD的结合亲和力提升至24.1 pM,比单一靶向的纳米抗体高出两倍。关键的是,这种双靶点协同机制不仅对HSV-1/2的病毒附着前阶段与附着后阶段均有强效的中和能力,还能显著的抑制病毒的细胞间传播,抑制率超过90%,在体内模型中,1mg/kg剂量即可使HSV-1颅内感染的小鼠存活率达80%,并能快速治愈阿昔洛韦耐药株引发的角膜溃疡,同时通过Fc段激活免疫效应,为干预病毒潜伏微环境提供了可能。
而今天,这项来自德国汉堡结构系统生物学中心等机构的研究不仅填补了HSV膜融合机制的研究空白,更为抗病毒治疗与疫苗研发提供了“结构-功能”双驱动的新路径,该研究还更进一步地验证了纳米抗体在抗HSV病毒领域的优势,纳米抗体凭借“小分子+高特异性”可精准靶向HSV的亚稳态表位,且“跨血清型+耐药性低”的特性突破了现有治疗性抗体的研究局限,为临床治疗研究提供了关键工具。
结合这两项研究,纳米抗体有望改变现有治疗格局,而研究本身的技术策略与结构策略,将持续推动纳米抗体在更广泛抗病毒领域的应用,为全球公共卫生安全贡献力量。

武汉纳博生命科技有限公司是由武汉产业创新发展研究院牵头成立建设的纳米抗体产业平台。其总部位于武汉东湖新技术开发区武创院本部大楼,在武汉生物城精准医疗产业基地拥有占地面积达1400㎡的自主实验室,并在武汉左岭与黄冈团风分别建立了符合实验动物标准的羊驼实验基地与转运基地,目前基地在饲养的羊驼共600余头,可为科研机构及抗体药物研发企业提供“零免疫背景”保障的羊驼免疫服务。
纳博生命专注于纳米抗体开发、改造与应用,致力于构建产、学、研一体化的实验公共服务平台。现拥有从抗原制备(多肽、蛋白及RNA),到抗体发现和抗体工程,再到生物学功能验证/筛选的全链路技术平台。其中RNA抗原包括针对羊驼进行RNA结构和序列优化的RNA;抗体发现与抗体工程服务采用噬菌体展示、RNA以及哺乳动物细胞展示在内的多种技术路线。通过多平台的交叉互补为药企及科研院所提供灵活的抗体发现及改造服务,助力药物试剂的研发。
除纳米抗体天然文库外,纳博生命科技还推出了现货免疫库,帮助客户快速筛选符合需求的抗体分子。
联系方式:400-822-9180 丨 联系邮箱:marketingdept@nanobodylife.com