- 文章信息
- 上一级分类: 知识文库
- 点击数:171
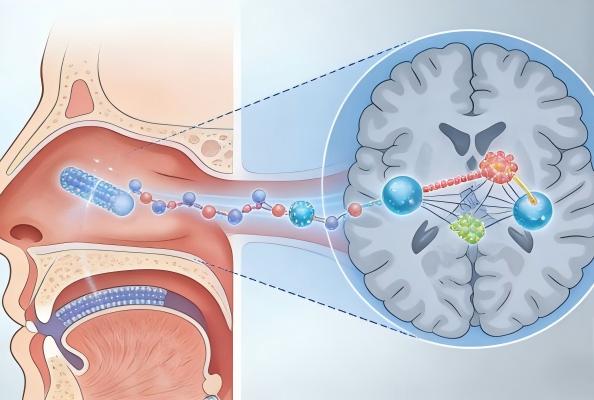
近期一支国际联合科研团队在顶级期刊《自然·通讯》上发表了一项具有里程碑意义的研究。他们首次成功开发出一种靶向新型大脑受体“代谢型甘氨酸受体(mGlyR)”的纳米抗体(Nb20),并通过非侵入性的鼻内给药方式,在小鼠模型中实现了快速、强效且持久的抗抑郁效果。这项研究不仅验证了mGlyR作为抗抑郁新靶点的巨大潜力,更展示了纳米抗体作为治疗脑部疾病新型生物制剂的可行性,为难以治愈的神经精神疾病带来了全新的治疗范式。
那么,这项被誉为“里程碑”的研究具体取得了哪些关键发现?其作用机制又是怎样的?
- 文章信息
- 上一级分类: 知识文库
- 点击数:286
在癌症免疫治疗的黄金赛道上,以PD-1(程序性死亡受体1)为靶点的免疫治疗虽已成为经典范式,但其单靶点策略在临床响应率与耐药性上面临瓶颈。随着对肿瘤免疫逃逸机制认知的不断深化,作为PD-1的关键配体,PD-L1(细胞程序性死亡配体1)逐渐从“背景通路”走向“舞台中央”,成为新一代免疫联合治疗与多机制协同干预的核心靶点之一。自首个抑制剂获批以来,它凭借明确的作用机制、广谱的抗癌效果,改写了无数癌症患者的治疗结局,而纳米抗体的崛起,正破解其临床应用瓶颈,结合2026年最新研究成果,这个经典靶点的潜力持续爆发。
今天,我们就循着PD-L1的研发脉络,聊聊它的核心价值、最新突破,以及纳米抗体如何成为其“破局关键”!
- 文章信息
- 上一级分类: 知识文库
- 点击数:320
尽管疫苗和抗病毒药物在不断进步,但呼吸道病毒感染的预防和传播在全球范围内仍面临着重大挑战。现有方法的一个明显局限是,它们无法在感染初始部位(呼吸道黏膜)提供强效保护。近日,在 nature nanotechnology上发表的一篇文章《Engineered mucus-tethering bispecific nanobodies enhance mucosal immunity against respiratory pathogens》其研究结果表明,设计策略通过阻断病毒入侵和限制传播链,为增强呼吸道病毒的黏膜防御提供了新思路。本文章研究者设计了一种黏液锚定双特异性纳米抗体。其设计目的是通过结合病毒表面蛋白来中和病毒,同时通过将病毒固定在黏蛋白上,将其捕获在黏液层中。与传统的非黏液锚定纳米抗体相比,这些双特异性纳米抗体在呼吸道中的滞留时间增加,为小鼠提供了更强的抗流感病毒感染保护,并减少了仓鼠模型中的SARS-CoV-2传播。接下来我们就一起来看一下这项研究获得的成果以及它带来的意义。
- 文章信息
-
浏览其他语言:

- 上一级分类: 知识文库
- 点击数:220
近期Nature Communications报道了一项重要突破:研究者成功开发出一种能精准“遥控”心脏起搏开关的纳米抗体NB5。本研究首次报道了一种能够从细胞外侧特异性结合并激活HCN4离子通道的纳米抗体NB5。这项工作不仅为治疗心脏起搏功能障碍提供了全新的候选治疗策略,更重要的是,它揭示了一种 “非经典”的电机械耦合机制,挑战了对HCN通道门控原理的传统认知。接下来我们就一起来看一下这项研究以及它的意义。

- 文章信息
-
浏览其他语言:

- 上一级分类: 知识文库
- 点击数:323
目前对于FEVR等疾病,现有手段(激光、手术)仅能处理并发症(如出血、脱离),无法从根本上纠正血管发育缺陷,针对病因的疗法是一片空白。然而2024年,勃林格殷格翰以潜在总额5.99亿美元引进FZD4激动剂SZN-413。这不仅是单一项目的交易,更是顶级药企对整个靶点生物学和转化路径的强力认可。SZN-413的研发意味着在眼科疾病的治疗方向上指出了一条新的道路。接下来我们就来认识一下FZD4(卷曲蛋白4)靶点。
- 文章信息
-
浏览其他语言:

- 上一级分类: 知识文库
- 点击数:498
Yes-associated protein(YAP)是一种以非活性形式存在于细胞质中的癌蛋白,作为Hippo信号通路的关键效应因子,在细胞增殖、分化调控中发挥核心作用,其异常激活会推动肿瘤发生发展,并与肿瘤恶性程度、复发转移及化疗耐药性密切相关。
- 文章信息
-
浏览其他语言:

- 上一级分类: 知识文库
- 点击数:406
CD19是免疫球蛋白超家族的I型跨膜糖蛋白,为B细胞特异性标志物,在B细胞发育全程持续表达,终末分化为浆细胞时消失。由于其本身不具备激酶活性,因此需要与CD21、CD81等蛋白形成B细胞共受体复合物来发挥作用,作为B细胞受体(BCR)的共受体,当BCR识别抗原时,它可协同BCR将抗原蛋白拉近并加强结合程度,然后迅速激活CD19胞内段相连的Lyn等激酶,同时强力招募并激活下游关键的PI3K、Vav、PLC-γ等信号分子,通过该机制可增强 BCR介导的信号传导,显著降低了B细胞活化阈值,使免疫应答变得更加灵敏高效。
- 文章信息
-
浏览其他语言:

- 上一级分类: 知识文库
- 点击数:374
c-MET(细胞间质上皮转换因子/肝细胞生长因子受体/HGFR)是一种由MET原癌基因编码的受体酪氨酸激酶,由胞外配体结合区、跨膜区和胞内酪氨酸激酶结构域组成,主要存在于细胞表面,唯一配体为肝细胞生长因子(HGF)。其功能正常时,与配体HGF结合后,可激活下游信号通路,调控细胞的增殖、迁移、分化、存活及组织修复,对胚胎发育和成人组织稳态至关重要,但当MET基因发生突变、扩增、过表达或发生14号外显子跳跃时,会导致c-MET信号通路被异常、持续激活,从而驱动肿瘤的生长、侵袭、转移和血管生成,也是导致EGFR靶向药耐药的主要机制之一。





